题目内容
在室温下,下列叙述正确的是( )
分析:根据溶液中PH值的稀释计算可知,强酸稀释10n倍,稀释后溶液的PH为PH+n,但不会超过7,而弱酸的变化程度小;酸碱中和时利用碱的物质的量来分析消耗的酸的多少,并利用酸的化学式与酸的PH来分析溶液中的离子浓度.
解答:解:A、因1.0×10-5mol/L的盐酸溶液其PH=5,稀释1000倍时PH不会大于7,故A错误;
B、若为pH=3的一元强酸稀释10倍PH应为4,而弱酸在稀释时变化小,则若溶液的pH<4,此酸为弱酸,故B正确;
C、因pH=13NaOH溶液和氨水,氨水为弱碱溶液,则氨水的浓度大,等体积等PH值的两种碱中氨水中溶质的物质的量大,则消耗的盐酸多,故C错误;
D、pH=2的盐酸中c(Cl-)=0.01mol/L,而pH=1的硫酸溶液中,硫酸为二元酸,则c(SO42-)=0.05mol/L,故D错误;
故选:B.
B、若为pH=3的一元强酸稀释10倍PH应为4,而弱酸在稀释时变化小,则若溶液的pH<4,此酸为弱酸,故B正确;
C、因pH=13NaOH溶液和氨水,氨水为弱碱溶液,则氨水的浓度大,等体积等PH值的两种碱中氨水中溶质的物质的量大,则消耗的盐酸多,故C错误;
D、pH=2的盐酸中c(Cl-)=0.01mol/L,而pH=1的硫酸溶液中,硫酸为二元酸,则c(SO42-)=0.05mol/L,故D错误;
故选:B.
点评:本题考查有关溶液中PH的计算及酸碱中和的计算,明确酸的强弱、几元酸等是解答的关键,并学会利用PH来分析物质的浓度来分析解答即可.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
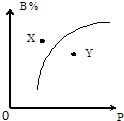 mA(s)+nB(g)?pC(g);△H<0,在室温条件下B的体积分数(B%)与压强(P)的关系如图所示,则下列有关叙述中一定正确的是( )
mA(s)+nB(g)?pC(g);△H<0,在室温条件下B的体积分数(B%)与压强(P)的关系如图所示,则下列有关叙述中一定正确的是( )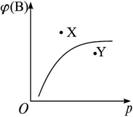
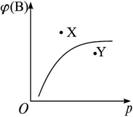
 pC(g);ΔH<0,在室温条件下B的体积分数(B%)与压强(P)的关系如图所示。
pC(g);ΔH<0,在室温条件下B的体积分数(B%)与压强(P)的关系如图所示。