题目内容
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是( )
| A.脱氧过程是吸热反应,可降低温度,延长糕点保质期 |
| B.脱氧过程中铁作原电池正极,电极反应为:Fe-3e=Fe3+ |
| C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e=4OH- |
| D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
D
解析试题分析:在脱氧过程中,由铁、碳做电极,氯化钠溶液做电解质溶液形成原电池,发生吸氧腐蚀,该过程为放热反应;在脱氧过程中,碳做正极,铁做负极,失电子发生氧化反应生成Fe2+;在脱氧过程中,Fe失电子氧化为Fe2+,Fe2+最终还是被氧气氧化为Fe3+,由电子守恒知消耗氧化剂氧气的体积(标况下)V(O2)=22.4L·mol-1×(3×1.12g/56g·mol-1)/4=336mL。
考点:电化学基础知识,涉及原电池电极的判断、电极方程式的书写,氧化还原的计算等相关知识。

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
两电极用导线连接插入电解质溶液中(不考虑溶液中溶解的氧气的影响),你认为不能构成原电池的是( )
| 选项 | A | B | C | D |
| 电极材料 | Zn | Fe | Cu | Al |
| 电极材料 | Cu | Zn | Ag | C |
| 电解质溶液 | CuCl2 溶液 | H2SO4溶液 | CuSO4 | NaOH溶液 |
如下图所示的两个实验装置,溶液的体积均为200mL。开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液的体积变化,下列叙述中正确的是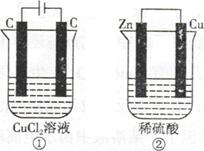
| A.产生气体的体积:①>② |
| B.溶液的pH变化:①减小,②增大 |
| C.电极上生成物质的质量:①=② |
| D.电极反应式:①中阳极2Cl—-2e—=Cl2↑,②中负极2H++2e—=H2↑ |
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O电解,Al2O3+3H2↑
电解过程中,以下判断正确的是 ( )。
| | 电池 | 电解池 |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗3 mol Pb | 生成2 mol Al2O3 |
| C | 正极:PbO2+4H++2e=Pb2++2H2O- | 阳极:3Al+3H2O-6e- =Al2O3+6H+ |
| D |  |  |
某学生将电流表用导线与两个电极连接在一起,再将两个电极同时插入某种电解质溶液中,能观察到有电流产生的是( )。
| A.用铜片、铅笔芯作电极插入稀硫酸中 |
| B.用两个铜片作电极插入硝酸银溶液中 |
| C.用锌片、铜片作电极插入番茄中 |
| D.用铜片、铁片作电极插入酒精中 |
一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是( )
| A.CH3OH(g)+O2(g)-2e-=H2O(l)+CO2(g)+2H+(aq) |
| B.O2(g)+4H+(aq)+4e-=2H2O(l) |
| C.CH3OH(g)+H2O(l)-6e-=CO2(g)+6H+(aq) |
| D.O2(g)+2H2O(l)+4e-=4OH- |

 向B电极移动
向B电极移动
