题目内容
下列有关说法正确的是
| A.锌与稀硫酸反应时加入少量硫酸铜,反应加快的原因是Cu2+水解增大了H+浓度 |
| B.增大醋酸溶液的浓度,溶液中c(OH-)减小的原因是水的离子积Kw减小 |
| C.pH=3的盐酸与pH=11的LiOH溶液等体积混合溶液呈碱性,说明LiOH为强碱 |
| D.TATP(C8H18O6)受撞击分解爆炸,且无明显热效应,说明该分解反应熵显著增加 |
D
解析试题分析:A、锌与硫酸反应时加少量硫酸铜,锌置换出铜,形成原电池,加快反应速率,错误;B、水的离子积随温度变化而变化,错误;C、pH=3的盐酸与pH=11的LiOH溶液等体积混合溶液呈碱性,说明氢氧化锂是弱碱,错误;TATP受撞击自发反应,△H≈0,说明反应△S>0,正确。
考点: 影响化学反应速率的因素 弱电解质的电离平衡 溶液的酸碱性与pH 化学反应进行的方向

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
盐酸与过量铁粉的反应,若有CH3COONa(s,适量)介入,则有
| A.反应速率减缓 | B.产生氢气的总量不变 |
| C.溶液的pH减小 | D.溶液中c(OH-)减小 |
下列有关化学概念或原理的论述中,正确的是
| A.Cl2、SO2、NH3的水溶液都能够导电,因此都属于电解质 |
| B.任何一个氧化还原反应都可以设计为电池,输出电能 |
| C.任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 |
| D.电解饱和食盐水的过程中,水的电离平衡正向移动 |
在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:
Ni(s)+4CO(g)  Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为
Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为
5×104和2,下列说法正确的是
| A.上述生成Ni(CO)4(g)的反应为吸热反应 |
| B.在80℃时,测得某时刻,Ni(CO)4 、CO浓度均为0.5 mol·L-1,则此时v(正)<v(逆) |
| C.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 |
| D.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大 |
下列有关说法正确的是 ( )
| A.反应:2CO(g) +2NO(g) |
B.0.1mol·L-1'Na2 CO3溶液加蒸馏水稀释,CO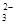 '的水解程度变大,溶液的pH不断增大 '的水解程度变大,溶液的pH不断增大 |
| C.电解精炼铜过程中,阳极质量的减少量与阴极质量的增加量一定相等 |
D.C(s) +CO2(g) 2CO(g)△H>0,其他条件不变时升高温度,反应速率v(CO2)和CO2的平衡转化率均增大 2CO(g)△H>0,其他条件不变时升高温度,反应速率v(CO2)和CO2的平衡转化率均增大 |
碘钨灯比白炽灯使用寿命长。灯管内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g)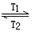 WI2(g) ΔH<0(温度T1<T2)。下列说法正确的是
WI2(g) ΔH<0(温度T1<T2)。下列说法正确的是
| A.灯管工作时,扩散到灯丝附近高温区的WI2(g)会分解出W,W重新沉积到灯丝上 |
| B.灯丝附近温度越高,WI2(g)的转化率越低 |
C.该反应的平衡常数表达式是 |
| D.利用该反应原理可以提纯钨 |
甲酸甲酯水解反应方程武为:HCOOCH3(aq)+H2O(l) HCOOH(aq)+CH3OH(aq) △H>0。某温度下,VL溶液中各组分的起始量如下表,HCOOCH3转化率随反应时间(t)的变化如下图(假设溶液体积不变),下列说法正确的是
HCOOH(aq)+CH3OH(aq) △H>0。某温度下,VL溶液中各组分的起始量如下表,HCOOCH3转化率随反应时间(t)的变化如下图(假设溶液体积不变),下列说法正确的是
| A.温度升高,该反应的平衡常数减小 |
| B.0?10min,HCOOCH3的平均反应速率 u="0." 003mol·L-1 ? min-1 |
| C.HCOOCH3平均反应速率先是增大,后减小,最后保持不变 |
| D.80min时,反应刚达平衡,反应物转化率保持不变 |
在一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g) 2C(g) △H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是
2C(g) △H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是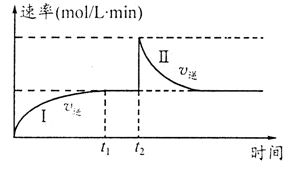
| A.0~t2时,v正>v逆 |
| B.t2时刻改变的条件可能是加催化剂 |
| C.Ⅰ、Ⅱ两过程达到反应限度时,A的体积分数Ⅰ=Ⅱ |
| D.Ⅰ、Ⅱ两过程达到反应限度时,平衡常数I<Ⅱ |
 2B(g)+C(g);②A(g)
2B(g)+C(g);②A(g)