题目内容
【题目】为减少煤炭燃烧过程 SO2 的排放,可采用固硫技术把 SO2 转化为 CaSO4的形式固定。已知:
CaSO4(s)+CO(g) ![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol (Ⅰ)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol (Ⅰ)
CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g), △H2=-175.6 kJ/mol (Ⅱ)
CaS(s)+4CO2(g), △H2=-175.6 kJ/mol (Ⅱ)
2CO(g)+O2![]() 2CO2(g) △H3=-566.0 kJ/mol (III)
2CO2(g) △H3=-566.0 kJ/mol (III)
(1)写出用 CaO(s)固硫转化为 CaSO4(s)的热化学方程式____________。
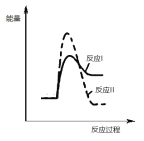
(2)煤炭燃烧过程中产生的 CO 与 CaSO4 反应, 降低脱硫效率。研究表明,在相同温度温度下,反应Ⅰ的速率远大于反应Ⅱ的速率,请说明理由__________;在同一个图中画出反应Ⅰ和反应Ⅱ的反应过程与能量变化示意图。_____________
(3)下列措施有助于反应(I)向逆反应方向移动的是__________。
A.升高温度 B.鼓入一定量 CO2 C.鼓入一定量 O2 D.加入负催化剂
(4)用 NaOH 溶液吸收足量的 SO2得到 NaHSO3 溶液, 以 Pt 为电极电解 NaHSO3溶液可制得硫酸。 请写出阳极的电极反应式________________。
【答案】 2CaO(s)+2SO2(g)+O2(g) ![]() 2CaSO4(s) △H3=-1002.8 kJ/mol 反应Ⅰ的活化能远小于反应Ⅱ的活化能
2CaSO4(s) △H3=-1002.8 kJ/mol 反应Ⅰ的活化能远小于反应Ⅱ的活化能 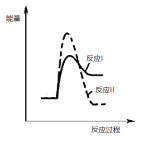 BC HSO3- - 2e- +H2O=SO42-+ 3H+
BC HSO3- - 2e- +H2O=SO42-+ 3H+
【解析】(1)已知:CaSO4(s)+CO(g) ![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol (Ⅰ); 2CO(g)+O2
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol (Ⅰ); 2CO(g)+O2![]() 2CO2(g) △H3=-566.0 kJ/mol (III)。由盖斯定律可知,(III)- (Ⅰ)
2CO2(g) △H3=-566.0 kJ/mol (III)。由盖斯定律可知,(III)- (Ⅰ) ![]() 可得到用 CaO(s)固硫转化为 CaSO4(s)的热化学方程式:2CaO(s)+2SO2(g)+O2(g)
可得到用 CaO(s)固硫转化为 CaSO4(s)的热化学方程式:2CaO(s)+2SO2(g)+O2(g) ![]() 2CaSO4(s) △H3=-1002.8 kJ/mol。
2CaSO4(s) △H3=-1002.8 kJ/mol。
(2)煤炭燃烧过程中产生的 CO 与 CaSO4 反应, 降低脱硫效率。研究表明,在相同温度温度下,反应Ⅰ的速率远大于反应Ⅱ的速率,说明反应Ⅰ的活化分子百分数较高,其原因是:反应Ⅰ的活化能远小于反应Ⅱ的活化能;反应Ⅰ为吸热反应、反应Ⅱ为放热反应,反应Ⅰ和反应Ⅱ的反应过程与能量变化示意图如下:
(3)反应Ⅰ为气体分子数增大的吸热反应。下列措施A.升高温度,平衡右移;B.鼓入一定量 CO2 ,增大生成物浓度,平衡逆向移动;C.鼓入一定量 O2 有利于CO转化为CO2,平衡逆向移动;D.加入负催化剂,只能减小反应速率,平衡不移动。综上所述,有助于反应(I)向逆反应方向移动的是BC。
(4)用 NaOH 溶液吸收足量的 SO2得到 NaHSO3 溶液,以 Pt 为电极电解 NaHSO3溶液可制得硫酸。由题意知,阳极上HSO3- 失去电子被氧化为SO42-,电极反应式HSO3- - 2e- +H2O=SO42-+ 3H+。

 学习实践园地系列答案
学习实践园地系列答案【题目】下表列出了某短周期元素R的各级电离能数据(单位为kJ·mol-1)。下列关于元素R的判断中一定正确的是( )
I1 | I2 | I3 | I4 | …… | |
R | 577.5 | 1816.7 | 2744.8 | 11577 |
①R的主要化合价中最高正价为+3价 ②R元素位于元素周期表中第ⅡA族
③R元素第一电离能小于同周期相邻元素 ④R元素基态原子的电子排布式为1s22s22p1
A. ①② B. ②③ C. ③④ D. ①③