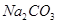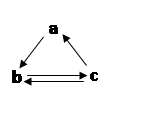题目内容
(10分)已知X、Y、Z是阳离子,K是阴离子,M、N是分子。它们都由短周期元素组成,且具有以下结构特征和性质:
①它们的核外电子总数都相同;
②N溶于M中,滴入酚酞,溶液变红;
③Y和K都由A.B两元素组成,Y核内质子数比K多2个;
④X和N都由A、C两元素组成,X和Y核内质子总数相等;
⑤X和K的浓溶液在加热条件下生成M和N;
⑥Z为单核离子,向含有Z的溶液中加入少量含K的溶液,有白色沉淀生成,再加入过量的含K或Y的溶液,沉淀消失。
回答下列问题:
(1)Y的化学式为 ;N的电子式为
(2)试比较M和N的稳定性:M (填“>”或“<”)N。
(3)写出Z和N的水溶液反应的离子方程式: ;
(4))上述六种微粒中的两种可与硫酸根形成一种含三种离子的盐,向该盐的浓溶液中逐滴加入0.1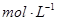 的NaOH溶液,出现了如图中a、b、c三个阶段的图像,
的NaOH溶液,出现了如图中a、b、c三个阶段的图像,
①写出b阶段的离子方程式:
②根据图像判断该盐的化学式为 。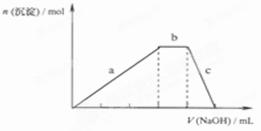
①它们的核外电子总数都相同;
②N溶于M中,滴入酚酞,溶液变红;
③Y和K都由A.B两元素组成,Y核内质子数比K多2个;
④X和N都由A、C两元素组成,X和Y核内质子总数相等;
⑤X和K的浓溶液在加热条件下生成M和N;
⑥Z为单核离子,向含有Z的溶液中加入少量含K的溶液,有白色沉淀生成,再加入过量的含K或Y的溶液,沉淀消失。
回答下列问题:
(1)Y的化学式为 ;N的电子式为
(2)试比较M和N的稳定性:M (填“>”或“<”)N。
(3)写出Z和N的水溶液反应的离子方程式: ;
(4))上述六种微粒中的两种可与硫酸根形成一种含三种离子的盐,向该盐的浓溶液中逐滴加入0.1
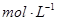 的NaOH溶液,出现了如图中a、b、c三个阶段的图像,
的NaOH溶液,出现了如图中a、b、c三个阶段的图像,①写出b阶段的离子方程式:
②根据图像判断该盐的化学式为 。

(9分)(1)H3O+ (1分) 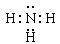 (1分)(2)>(1分)
(1分)(2)>(1分)
(3) Al3++3NH3·H2O = Al(OH)3↓+3NH4+ (2分)
(4)①NH4++OH-= NH3·H2O (2分)②NH4Al(SO4)2 (2分)
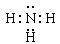 (1分)(2)>(1分)
(1分)(2)>(1分)(3) Al3++3NH3·H2O = Al(OH)3↓+3NH4+ (2分)
(4)①NH4++OH-= NH3·H2O (2分)②NH4Al(SO4)2 (2分)
试题分析:N溶于M中,滴入酚酞,溶液变红,则N应该是氨气,M是水。X和K的浓溶液在加热条件下生成M和N,所以X和K分别是NH4+和OH-。Y和K都由A、B两元素组成,Y核内质子数比K多2个,所以Y是H3O+;Z为单核离子,向含有Z的溶液中加入少量含K的溶液,有白色沉淀生成,再加入过量的含K或Y的溶液,沉淀消失,所以Z是 Al3+。
(1)Y的化学式为H3O+;氨气是共价化合物,电子式为
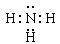 。
。(2)非金属性越强,氢化物的稳定性越强,氧元素的非金属性强于氮元素的,所以水的稳定性强于氨气的。
(3)氢氧化铝是两性氧化物,但不能溶于氨水中,所以该反应的方程式是 Al3++3NH3·H2O =Al(OH)3↓+3NH4+。
(4)根据图像可知,产生的沉淀应该是氢氧化铝。又因为中间一段沉淀是不变的,这说明还含有NH4+,所以b阶段的离子方程式是NH4++OH-= NH3·H2O;根据微粒的电荷数可知,该盐的化学式是NH4Al(SO4)2 。
点评:本题主要是以常见微粒的结构和性质,综合考查学生对基础知识的掌握程度以及灵活运用知识解决实际问题的能力。

练习册系列答案
相关题目
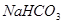 ②
②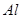 ③
③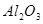 ④
④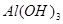 ⑤
⑤