题目内容
4.将8gSO3投入水中制成250mL溶液,此溶液的溶质是H2SO4,其物质的量浓度为0.4mol/L,取出50mL溶液,其中含有该溶质1.96g,将取出的溶液加水稀释至200mL,稀释后该溶质的物质的量浓度为0.1mol/L.分析 n(SO3)=$\frac{8g}{80g/mol}$=0.1mol,与水发生SO3+H2O=H2SO4,结合c=$\frac{n}{V}$计算浓度,以此解答该题.
解答 解:n(SO3)=$\frac{8g}{80g/mol}$=0.1mol,与水发生SO3+H2O=H2SO4,溶液的溶质是H2SO4,c(H2SO4)=$\frac{0.1mol}{0.25L}$=0.4mol/L,
取出50mL溶液,其中含有该溶质的质量为0.4mol/L×0.05L×98g/mol=1.96g,
将取出的溶液加水稀释至200mL,稀释后该溶质的物质的量浓度为$\frac{0.4mol/L×0.05L}{0.2L}$=0.1mol/L,
故答案为:H2SO4;0.4mol/L;1.96;0.1mol/L.
点评 本题综合考查物质的量的计算,为高频考点,侧重于学生的分析能力的考查,注意把握相关计算公式的运用,难度不大.

练习册系列答案
相关题目
19.实验测定NaHCO3溶液显碱性,下列说法中正确的是( )
| A. | 在水溶液中,HCO3-仅仅发生水解 | |
| B. | 在水溶液中,HCO3-仅仅发生电离 | |
| C. | 在水溶液中,HCO3-的水解程度要大于电离程度 | |
| D. | 在水溶液中,HCO3-的电离程度要大于水解程度 |
9.下列关于油脂的说法正确的是( )
| A. | 多吃动物脂肪比多吃植物油有利 | |
| B. | 油脂在体内直接氧化产生热量 | |
| C. | 油脂均为固态 | |
| D. | 有些脂肪酸是人体必需的,但人体内却不能合成 |
16.含一个双键的烯烃,与氢气加成后的产物结构简式如图,此烯烃可能有的结构有( )

| A. | 1种 | B. | 3种 | C. | 5种 | D. | 7种 |
13.下列溶液中,溶质的物质的量浓度不是1mol/L的是( )
| A. | 10g NaOH固体溶解在水中配成250mL溶液 | |
| B. | 将80g SO3溶于水并配成1L的溶液 | |
| C. | 将100mL浓度为0.5mol/L的NaNO3溶液加热蒸发50克水 | |
| D. | 标况下,将22.4L氯化氢气体溶于水配成1L溶液 |
10. 苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理如下:
苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理如下:
 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +2MnO2↓+KOH+H2O
+2MnO2↓+KOH+H2O
 +HCl→
+HCl→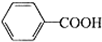 ↓+KCl
↓+KCl
相关资料:
实验步骤:
如图组装反应装置(冷凝水.夹持及加热装置未画出),并在三颈烧瓶中依次加入120mL水、9,.4g高锰酸钾和3.0mL甲苯.
②将三颈烧瓶中的混合液体搅拌,加热至沸腾,直到甲苯完全反应.
③趁热过滤反应混合物.若滤液呈紫色,则需加入适量的亚硫酸氢钠溶液至紫色褪去后再过滤,用热水洗涤滤渣,洗涤液合并至滤液中.
④用冰水冷却滤液,然后用浓盐酸酸化,过滤,用少量冷水洗涤滤渣,得到苯甲酸粗产品,经重结晶得到精制的苯甲酸.
回答下列问题:
(1)本实验应选择的三颈烧瓶规格为B(填字母序号).
A.100mL B.250mL C.500mL D.1000mL
(2)判断甲苯已完全反应的现象是三颈烧瓶中混合液不再分层、回流液不再出现油珠.
(3)实验步骤④中,用少量冷水而不用热水洗涤滤渣的目的是减少苯甲酸因溶解造成损失;苯甲酸粗产品除了可用重结晶法精制外,还可用B法.
A.蒸发 B.升华 C.过滤 D.分液
(4)精制的苯甲酸纯度测定:称取1.220g样品,用稀乙醇溶解并配成100mL溶液,分别取25,.00mL溶液,用0.1000mo1•L-1NaOH标准溶液滴定,三次滴定消耗NaOH溶液的体积分别为V1=24.70mL、V2=24.80mL、V3=25.80mL.
①配制溶液时用稀乙醇而不用蒸馏水作溶剂的原因是常温下苯甲酸微溶于水易溶于乙醇.
②若用酚酞作指示剂,确定滴定终点的现象是滴加最后一滴氢氧化钠标准溶液后,溶液由无色变为浅红色,且30秒不褪色.
③产品的纯度为99.00%.
 苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理如下:
苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理如下: +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +2MnO2↓+KOH+H2O
+2MnO2↓+KOH+H2O +HCl→
+HCl→ ↓+KCl
↓+KCl相关资料:
| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 溶解度 | |
| 水 | 乙醇 | ||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -96 | 不溶 | 易容 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 (100℃升华) | 25℃0.35g 80℃2.7g | 易容 |
如图组装反应装置(冷凝水.夹持及加热装置未画出),并在三颈烧瓶中依次加入120mL水、9,.4g高锰酸钾和3.0mL甲苯.
②将三颈烧瓶中的混合液体搅拌,加热至沸腾,直到甲苯完全反应.
③趁热过滤反应混合物.若滤液呈紫色,则需加入适量的亚硫酸氢钠溶液至紫色褪去后再过滤,用热水洗涤滤渣,洗涤液合并至滤液中.
④用冰水冷却滤液,然后用浓盐酸酸化,过滤,用少量冷水洗涤滤渣,得到苯甲酸粗产品,经重结晶得到精制的苯甲酸.
回答下列问题:
(1)本实验应选择的三颈烧瓶规格为B(填字母序号).
A.100mL B.250mL C.500mL D.1000mL
(2)判断甲苯已完全反应的现象是三颈烧瓶中混合液不再分层、回流液不再出现油珠.
(3)实验步骤④中,用少量冷水而不用热水洗涤滤渣的目的是减少苯甲酸因溶解造成损失;苯甲酸粗产品除了可用重结晶法精制外,还可用B法.
A.蒸发 B.升华 C.过滤 D.分液
(4)精制的苯甲酸纯度测定:称取1.220g样品,用稀乙醇溶解并配成100mL溶液,分别取25,.00mL溶液,用0.1000mo1•L-1NaOH标准溶液滴定,三次滴定消耗NaOH溶液的体积分别为V1=24.70mL、V2=24.80mL、V3=25.80mL.
①配制溶液时用稀乙醇而不用蒸馏水作溶剂的原因是常温下苯甲酸微溶于水易溶于乙醇.
②若用酚酞作指示剂,确定滴定终点的现象是滴加最后一滴氢氧化钠标准溶液后,溶液由无色变为浅红色,且30秒不褪色.
③产品的纯度为99.00%.
 氨气是一种富氢燃料,可以直接用于燃料电池,如图是供氨水式燃料电池工作原理:
氨气是一种富氢燃料,可以直接用于燃料电池,如图是供氨水式燃料电池工作原理: