题目内容
在下列条件下,两种气体的分子数一定相等的是( )
| A.同温度、同体积的N2和O2 |
| B.同质量、不同密度的N2和CO |
| C.同压强、同体积的H2和CH4 |
| D.同体积、同密度的CO2和N2 |
B
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
加热21.2g KOH和KHCO3的混合物使其充分反应后冷却,称得固体质量减少1.8g,则
下列说法中正确的是(n表示物质的量)
| A.n(KOH) = 0.1mol | B.n(KOH) < n(KHCO3) |
| C.n(KHCO3) = 0.2mol | D.n(KOH) > n(KHCO3) |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.常温常压下,2.24 L CH4中含有0.4NA个共价键 |
| B.100 mL l mol·L-1 Na[Al(OH)4]溶液中含有0.1以个[Al(OH)4]- |
| C.常温条件下,5.6gFe与足量稀HNO3反应,转移0.2NA个电子 |
| D.标准状况下,1.12 L 1H2和0.2g2H2均含有0.1NA个质子 |
300 mL Al2(SO4)3溶液中,含Al3+为1.62 g,在该溶液中加入0.1 mol·L-1 Ba(OH)2溶液300 mL,反应后溶液中SO42-的物质的量浓度为( )
| A.0.4 mol·L-1 | B.0.3 mol·L-1 |
| C.0.2 mol·L-1 | D.0.1 mol·L-1 |
36.5 g HCl溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为ρ g/mL,质量分数为w,物质的量浓度为c mol/L,NA表示阿伏加德罗常数的值,则下列叙述中正确的是( )
| A.所得溶液的物质的量浓度为1 mol/L |
| B.所得溶液中含有NA个HCl分子 |
| C.36.5 g HCl气体占有的体积为22.4 L |
| D.所得溶液的质量分数:w="36.5c/(1" 000ρ) |
甲、乙、丙是三种不含相同离子的可溶性强电解质。它们所含离子如下表所示:
| 阳离子 | NH、Na+、Mg2+ |
| 阴离子 | OH-、NO3—、SO42— |
取等质量的三种化合物配制相同体积的溶液,其溶质物质的量浓度:c(甲)>c(乙)>c(丙),则乙物质可能是( )
①MgSO4 ②NaOH ③(NH4)2SO4 ④Mg(NO3)2 ⑤NH4NO3
A.①② B.③④ C.③⑤ D.①⑤
某学生用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(每次加入的盐酸的物质的量浓度相等),下列分析正确的是( )
| 盐酸/mL | 50 | 50 | 50 |
| m(混合物)/g | 9.2 | 15.7 | 27.6 |
| V(CO2)(标准状况)/L | 2.24 | 3.36 | 3.36 |
A.盐酸的物质的量浓度为3.2 mol·L-1
B.混合物中NaHCO3的质量分数为54.3%
C.9.2 g混合物中KHCO3的物质的量为0.05 mol
D.15.7 g混合物恰好与盐酸完全反应
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。利用图所示装置加热硫酸铜粉末直至完全分解。硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如下表所示。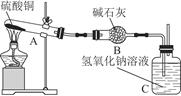
| 装置 | A(试管+粉末) | B | C |
| 反应前 | 42.0 g | 75.0 g | 140.0 g |
| 反应后 | 37.0 g | 79.5 g | 140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是( )
A.4CuSO4
 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑ B. 3CuSO4
 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑C.5CuSO4
 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑ D.6CuSO4
 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑