��Ŀ����
����Ŀ����ѧ�ϳ���AG��ʾ��Һ��lg ��25��ʱ����0.100mol��L-1��NaOH��Һ�ζ�20.00mL0.1mol��L-1��HNO2��Һ��AG������NaOH��Һ�����(V)�Ĺ�ϵ��ͼ��ʾ������˵������ȷ����
��25��ʱ����0.100mol��L-1��NaOH��Һ�ζ�20.00mL0.1mol��L-1��HNO2��Һ��AG������NaOH��Һ�����(V)�Ĺ�ϵ��ͼ��ʾ������˵������ȷ����
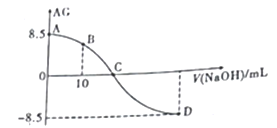
A. C��ʱ������NaOH��Һ�������Ϊ20mL
B. D����Һ��pH=11.25
C. B����Һ�д���2c(H+)-2c(OH-)=c(NO2-)-c(HNO2)
D. 25��ʱ��HNO2�ĵ��볣��Ka=1.0��10-5.5
���𰸡�D
��������A.��ͼ��֪C����ҺΪ���ԣ�����NaNO2ˮ��ʹ��Һ�ʼ��ԣ����C�㻹Ҫ��HNO2ʣ�����ʹ��Һ�����ԣ�������NaOH��Һ�������С��20 mL��A��ȷ��B.��D��
lg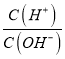 =8.5����
=8.5����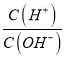 =1.0
=1.0![]() ��KW=
��KW= ![]() ��
��![]() ������
������![]() =
=![]() ��pH=11.25��B��ȷ��C.�������֪��Һ�е���غ��ϵ��c(Na+)+c(H+)=c(OH-)+c(
��pH=11.25��B��ȷ��C.�������֪��Һ�е���غ��ϵ��c(Na+)+c(H+)=c(OH-)+c(![]() )����ͼ��֪B����Һ��n(NaNO2)=n(HNO2)�������غ��ϵ��2c(Na+)=c(
)����ͼ��֪B����Һ��n(NaNO2)=n(HNO2)�������غ��ϵ��2c(Na+)=c(![]() ) +c(HNO2)����������غ�ɵ����¹�ϵʽ��2c(H+)-2c(OH-)=c(
) +c(HNO2)����������غ�ɵ����¹�ϵʽ��2c(H+)-2c(OH-)=c(![]() )-c(HNO2)��C��ȷ��D.A��ʱ��ҺΪHNO2������ͼ���֪lg
)-c(HNO2)��C��ȷ��D.A��ʱ��ҺΪHNO2������ͼ���֪lg![]() =8.5�����ˮ�����ӻ���c(H+) c(OH-)=10-14���ɼ����A��c(H+)=10-2.75molL-1����������ĵ���ƽ�ⳣ����Ka=
=8.5�����ˮ�����ӻ���c(H+) c(OH-)=10-14���ɼ����A��c(H+)=10-2.75molL-1����������ĵ���ƽ�ⳣ����Ka=![]() =
=![]() =1.0��10-4.5,D����ѡD.
=1.0��10-4.5,D����ѡD.

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�