题目内容
(2013?浙江模拟)下列关于甲、乙、丙、丁四个图象的说法中,不正确的是( )
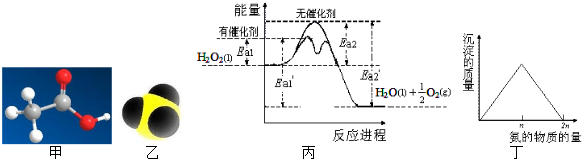

分析:A、根据甲是乙酸分子的球棍模型,醛基中所有的原子共面可知乙酸分子中所有碳原子和氧原子共面;
B.根据乙是氨分子的比例模型,1个NH3中含有共用电子对数为3个;
C.根据△H=旧键断裂吸收的能量-新键形成放出的能量以及物质的活化能的大小与反应热无关;
D.根据向AgNO3溶液中滴加稀氨水,先产生白色沉淀:AgNO3+NH3?H2O=AgOH↓+NH4NO3,继续滴加氨水,沉淀消失:AgOH+2NH3?H2O=[Ag(NH3)2]OH+2H2O分析两次消耗的氨水的量.
B.根据乙是氨分子的比例模型,1个NH3中含有共用电子对数为3个;
C.根据△H=旧键断裂吸收的能量-新键形成放出的能量以及物质的活化能的大小与反应热无关;
D.根据向AgNO3溶液中滴加稀氨水,先产生白色沉淀:AgNO3+NH3?H2O=AgOH↓+NH4NO3,继续滴加氨水,沉淀消失:AgOH+2NH3?H2O=[Ag(NH3)2]OH+2H2O分析两次消耗的氨水的量.
解答:解:A.甲是乙酸分子的球棍模型,由醛基中所有的原子共面可知乙酸分子中所有碳原子和氧原子共面,故A正确;
B.乙是氨分子的比例模型,1mol NH3中含有共用电子对数为3NA,故B正确;
C.由丙可知,双氧水在有催化剂存在时的热化学方程式为:2H2O2(l)═2H2O(l)+O2(g)△H=-2(Ea2′-Ea2) kJ?mol-1,故C正确;
D.向AgNO3溶液中滴加稀氨水,先产生白色沉淀:AgNO3+NH3?H2O=AgOH↓+NH4NO3,继续滴加氨水,沉淀消失:AgOH+2NH3?H2O=[Ag(NH3)2]OH+2H2O分析两次消耗的氨水的量之比为1:2,故D错误;
故选D.
B.乙是氨分子的比例模型,1mol NH3中含有共用电子对数为3NA,故B正确;
C.由丙可知,双氧水在有催化剂存在时的热化学方程式为:2H2O2(l)═2H2O(l)+O2(g)△H=-2(Ea2′-Ea2) kJ?mol-1,故C正确;
D.向AgNO3溶液中滴加稀氨水,先产生白色沉淀:AgNO3+NH3?H2O=AgOH↓+NH4NO3,继续滴加氨水,沉淀消失:AgOH+2NH3?H2O=[Ag(NH3)2]OH+2H2O分析两次消耗的氨水的量之比为1:2,故D错误;
故选D.
点评:本题主要考查了球棍模型、比例模型、热化学方程式的书写、方程式的书写等,难度不大,注意基础知识的积累.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
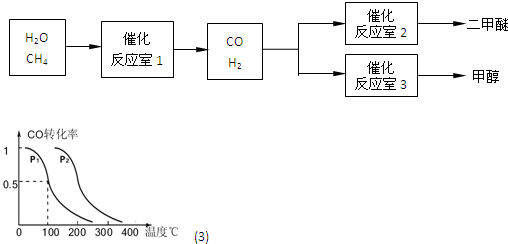
 CO(g)+3H2(g)△H>0.在其它条件不变的情况下降低温度,逆反应速率将
CO(g)+3H2(g)△H>0.在其它条件不变的情况下降低温度,逆反应速率将 CH3OCH3+H2O
CH3OCH3+H2O CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则: CO(g)+2H2(g)反应的平衡常数为
CO(g)+2H2(g)反应的平衡常数为