题目内容
下列图示与对应的叙述相符的是
| A.图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图2表示0.1000mol?L—1 NaOH溶液滴定20.00mL 0.1000mol?L—1 CH3COOH溶液的滴定曲线 |
| C.图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
| D.图4表示某可逆反应生成物的量随反应时间的变化,t时V正<V逆 |
A
解析试题分析:A.催化剂只改变活化能,不改变反应热,正确;B.0.1000mol?L—1 CH3COOH溶液PH值大于1,错误;C.图中a点所示的溶液是80℃时KNO3的过饱和溶液,错误;D.反应未达到平衡,生成物的量处在增加的阶段,所以t时应是向正反应方向进行,V正﹥V逆,错误。
考点:催化剂对化学反应的影响;弱电解质的部分电离及酸碱中和滴定曲线的分析;溶解曲线的分析;可逆反应的特点。

下列属于吸热反应的是
| A.CaO + H2O = Ca(OH)2 | B.C + H2O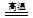 CO + H2 CO + H2 |
| C.NaOH + HCl =" NaCl" + H2O | D.2Mg + CO2 2MgO + C 2MgO + C |
下列说法或表示方法中正确的是( )
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B.由C(金刚石)→C(石墨)ΔH= -1.9KJ/mol 可知,金刚石比石墨稳定 |
| C.由2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1可知,H2的燃烧热为-571.6 kJ·mol-1 |
| D.稀溶液中:H+(aq)+OH—(aq)=H2O(l) ΔH= —53.7KJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于57.3KJ |
强酸和强碱在稀溶液中的中和热可表示为:H+(aq)+OH-(aq)=H2O(l);△H=" -57.3k" kJ·mol-1,
又知在溶液中反应有:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ;△H= -Q1kJ·mol-1 H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)= Na2SO4(aq)+H2O(l) ;△H= -Q2 kJ·mol-1
Na2SO4(aq)+H2O(l) ;△H= -Q2 kJ·mol-1
HCl(aq)+NaOH(aq)="=" NaCl(aq)+H2O(l) ;△H= -Q3 kJ·mol-1,
则Q1、Q2、Q3的关系正确的是
| A.Q1 =Q2 = Q3 | B.Q2 > Q3 > Q1 | C.Q2 > Q1 > Q3 | D.Q2 = Q3 > Q1 |
已知如下两个热化学反应方程式:

下列说法不正确的是 ( )
| A.反应①、②都属于加成反应 |
| B.在通常条件下,反应①、②都能自发进行 |
| C.反应①吸热、反应②放热的事实说明苯环中含有的并不是碳碳双键 |
| D.反应①、②中的所有有机物均可使溴水褪色,但褪色原理不完全相同 |
已知:断开1molN≡N需要吸收akJ热量,断开1molH—H需要吸收bkJ热量,断开1molN—H需要吸收ckJ热量。向某密闭容器中通入1molN2和3molH2,在一定条件下发生反应:N2(g)+3H2(g) 2NH3(g)(放热反应)。下列描述中正确的是
2NH3(g)(放热反应)。下列描述中正确的是
| A.N2和H2具有的总能量一定比NH3具有的总能量低 |
| B.a、b、c三者的关系为:a+3b<2c |
| C.向密闭容器中通入1molN2和3molH2,反应放出的热量必为(6c―a―3b)kJ |
| D.形成1molN—H会放出ckJ热量 |
用CH4催化还原NOx可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) △H=-574 kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ/mol
③H2O(g)=H2O(l) △H=-44kJ/mol。下列说法不正确的是
| A.等物质的量的CH4参加反应,反应①②转移的电子数相同 |
| B.CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-530 kJ/mol |
| C.0.2 mol CH4还原NO2至N2,且生成H2O(g)放出的热量为164.6 kJ |
| D.若用4.48 L(标准状况)CH4还原NO2至N2且生成H2O(g),整个过程中转移电子1.60 mol |
含氮废水中的NH4+在一定条件下可与O2发生以下反应:
① NH4+(aq) +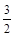 O2(g) = NO2-(aq) + 2H+(aq) + H2O(l) ΔH = -273kL/mol
O2(g) = NO2-(aq) + 2H+(aq) + H2O(l) ΔH = -273kL/mol
② NO2-(aq) +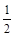 O2(g) = NO3-(aq) ΔH = -73kL/mol
O2(g) = NO3-(aq) ΔH = -73kL/mol
下列叙述不正确的是
| A.升高温度,可使①②反应速率均加快 |
| B.室温下时0.1 mol/L HNO2(aq) pH>1,则NaNO2溶液显碱性 |
| C.NH4+(aq) + 2O2(g) = NO3-(aq) + 2H+(aq) + H2O(l)ΔH = -346kJ/mol |
| D.1 mol NH4+在①反应中与1 mol NO2-在②反应中失电子数之比为1:3 |