题目内容
(10分)阅读下表中部分短周期主族元素的相关信息:
请回答:
(1)元素T与X按原子个数比1:1形成的化合物B的电子式为 ,该化合物中所含的化学键有 (填化学键名称)。
(2)单质T与冷水反应的化学方程式为
(3)将Y与Z形成的化合物的水溶液,逐滴加入到T的最高价氧化物对应水化物的溶液中直至过量(边滴加边振荡),写出此过程中发生反应的离子方程式
、 。
请回答:
| 元素代号 | 相关信息 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期的所用金属离子中,Y的离子半径最小 |
| Z | Z与Y同周期,是所在周期中原子半径最小的元素 |
| T | T的单质能与冷水剧烈反应,生成的强碱电离出两种电子数相等的阴、阳离子 |
(2)单质T与冷水反应的化学方程式为
(3)将Y与Z形成的化合物的水溶液,逐滴加入到T的最高价氧化物对应水化物的溶液中直至过量(边滴加边振荡),写出此过程中发生反应的离子方程式
、 。
(10分)(1)略,离子键、非极性共价键
(2)2Na+2H2O=2NaOH+H2↑
(3) Al3++4OH—= AlO2— +2H2O Al3++3AlO2— +6H2O=4Al(OH)3 ↓ (2分)
(2)2Na+2H2O=2NaOH+H2↑
(3) Al3++4OH—= AlO2— +2H2O Al3++3AlO2— +6H2O=4Al(OH)3 ↓ (2分)
考查元素推断及元素周期律
X的电子排布为2、6,即氧元素;
粒子半径决定于电子层数及核电荷数,第三周期中离子的电子层数较小的只有钠离子、镁离子及铝离子,且铝离子核电荷数最大,可知Y为铝元素;
Z是氯元素,第三周期中原子半径最小的元素
T元素为钠元素:短周期中能与冷水反应生成碱的只有钠元素
(1)化合物B为过氧化钠,其电子式为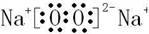
(2)钠与冷水反应:2Na+2H2O=2NaOH+H2↑
(3)AlCl3滴入NaOH溶液中,开始时碱绝对过量,发生的反应为:Al3++4OH—= AlO2— +2H2O;当溶质转变为AlO2—时,继续滴加AlCl3,则发生双水解反应:Al3++3AlO2— +6H2O=4Al(OH)3↓
X的电子排布为2、6,即氧元素;
粒子半径决定于电子层数及核电荷数,第三周期中离子的电子层数较小的只有钠离子、镁离子及铝离子,且铝离子核电荷数最大,可知Y为铝元素;
Z是氯元素,第三周期中原子半径最小的元素
T元素为钠元素:短周期中能与冷水反应生成碱的只有钠元素
(1)化合物B为过氧化钠,其电子式为
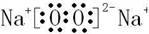
(2)钠与冷水反应:2Na+2H2O=2NaOH+H2↑
(3)AlCl3滴入NaOH溶液中,开始时碱绝对过量,发生的反应为:Al3++4OH—= AlO2— +2H2O;当溶质转变为AlO2—时,继续滴加AlCl3,则发生双水解反应:Al3++3AlO2— +6H2O=4Al(OH)3↓

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案
相关题目
 物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。 KBrO3
KBrO3
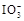 +5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在
+5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在
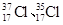 为不同的核素,
为不同的核素,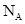 为阿伏加德罗常数,下列说法正确的是
为阿伏加德罗常数,下列说法正确的是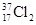 含有0.72
含有0.72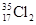 与
与