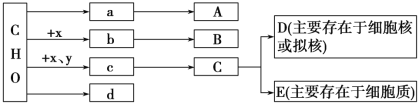
题目内容
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是
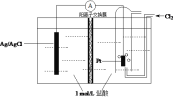
A. 负极反应为Ag-e-+Cl-=AgCl
B. 放电时,交换膜右侧溶液中pH升高
C. 当电路中转移0.1 mol e-,通过交换膜的阳离子为0.2 mol
D. 用KCl溶液代替盐酸,则电池总反应改变
【答案】A
【解析】
根据电池总反应为2Ag+Cl2=2AgCl 可以知道,Ag作负极、失电子,氯气在正极上得电子生成氯离子,
A、负极上银失电子生成银离子,银离子与氯离子结合成氯化银,其电极反应为: Ag-e-+Cl-=AgCl,A正确;
B、放电时,交换膜左侧的氢离子向正极移动,溶液酸性增强,交换膜右侧溶液中pH降低,B错误;
C、放电时,当电路中转移0.1 mol e-时,交换膜左则会有0.1 mol 氢离子通过阳离子交换膜向正极移动,故C错误;
D、根据电池总反应为2Ag+Cl2=2AgCl 可以知道,用KCl溶液代替盐酸,电池的总反应不变,故D错误;
综上所述,本题选A。

【题目】某温度时,在2 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如下表所示。
(1)根据下表中数据,在下图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:_________
t/min | X/mol | Y/mol | Z/mol |
0 | 1.00 | 1.00 | 0.00 |
1 | 0.90 | 0.80 | 0.20 |
3 | 0.75 | 0.50 | 0.50 |
5 | 0.65 | 0.30 | 0.70 |
9 | 0.55 | 0.10 | 0.90 |
10 | 0.55 | 0.10 | 0.90 |
14 | 0.55 | 0.10 | 0.90 |
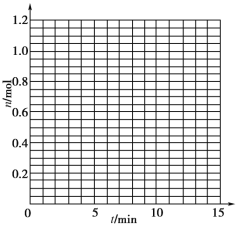
(2)体系中发生反应的化学方程式是___________________________________________;
(3)列式计算该反应在0~3 min时间内产物Z的平均反应速率:_________________________;
(4)该反应达到平衡时反应物X的转化率α等于__________________________________________ ;
(5)如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1、2、3所对应的实验条件改变分别是: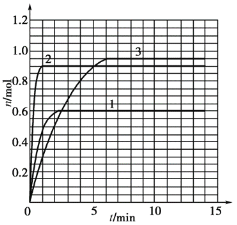 1___________________,2_______________________,3______________________。
1___________________,2_______________________,3______________________。