题目内容
【题目】铝氢化钠(NaAlH4)是有机合成的重要还原剂,其合成线路如下图所示。
![]()
(1)已知无水AlCl3在潮湿的空气中极易水解。某实验小组利用下图中部分装置制备无水AlCl3。
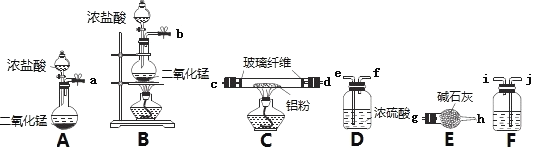
①实验室制备Cl2的反应中,MnO2的作用是________________________。
②该实验小组的实验装置,按气流方向连接各仪器接口,顺序为:_____________→g→h。
③装置F中应盛装的试剂是______________,装置E的作用是________________
(2)利用铝氢化钠遇水反应生成的氢气的体积测定铝氢化钠样品纯度。
①其反应的化学方程式为______________________________________
②现设计如下四种装置测定铝氢化钠样品的纯度(假设杂质不参与反应)。
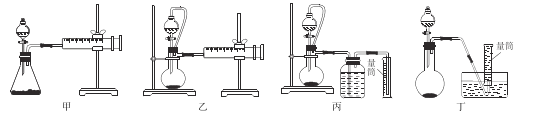
从简约性、准确性考虑,最适宜的方案是 _______(填编号),铝氢化钠与水完全反应,冷却至室温的标志(保证测量数值的准确性)是______________________________。
【答案】 氧化剂 b→j→i→e→f→c→d 饱和NaCl溶液 吸收Cl2尾气,并防止空气中的水蒸气进入装置C NaAlH4+2H2O=NaAlO2+4H2↑ 乙 待气体体积稳定后再读数或连续两次读取氢气的体积相等。
【解析】(1)①实验室利用二氧化锰和浓盐酸混合加热制Cl2,发生反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,在此反应中MnO2的作用是氧化剂;
MnCl2+Cl2↑+2H2O,在此反应中MnO2的作用是氧化剂;
②利用B装置制氯气,用F装置中的饱和食盐水除去Cl2混有的HCl,再利用D中浓硫酸干燥氯气,再通入装置C中制AlCl3,按气流方向连接各仪器接口的顺序为:b→j→i→e→f→c→d→g→h;
③有②分析可知装置F中应盛装的试剂是饱和食盐水,装置E中碱石灰的作用是吸收Cl2尾气,并防止空气中的水蒸气进入装置C;
(2)①铝氢化钠遇水反应生成氢气和偏铝酸钠,发生反应的化学方程式为NaAlH4+2H2O=NaAlO2+4H2↑;
②由反应原理得,测定铝氢化钠样品的纯度即通过测定铝氢化钠与水反应生成的氢气的量计算铝氢化钠的量,从而计算其纯度,所以从简约性、准确性考虑,最甲没有使用恒压漏斗,测出的氢气有误差;C、D采用排水法收集氢气,由于导管中会有残留,导致测出的氢气有误差,适宜的方案是乙;通过连续两次读数的氢气体积相等,说明铝氢化钠与水完全反应,冷却至室温。


