题目内容
(1)在Ca(HCO3)2溶液中加入足量的NaOH溶液;在NaOH溶液中加入足量的Ca(HCO3)2溶液,书写以上两离子反应方程式。(2)在明矾溶液中加入Ba(OH)2溶液,写出Al3+全部沉淀和Al(OH)3恰好全部溶解时的离子方程式。
解析:(1)酸式盐Ca(HCO3)2溶液和碱NaOH溶液两者混合时先发生中和反应:![]() +OH-====
+OH-====![]() +H2O,继而生成的
+H2O,继而生成的![]() 与Ca2+发生沉淀反应:Ca2++
与Ca2+发生沉淀反应:Ca2++![]() ====CaCO3↓。由于Ca(HCO3)2与NaOH的相对用量不同,离子方程式有所不同,令少量的物质为1mol,另一种物质的物质的量由中和反应和沉淀反应的最大量决定或共同决定。
====CaCO3↓。由于Ca(HCO3)2与NaOH的相对用量不同,离子方程式有所不同,令少量的物质为1mol,另一种物质的物质的量由中和反应和沉淀反应的最大量决定或共同决定。
Ca(HCO3)2中加入足量的NaOH:令Ca(HCO3)2为1mol,先考虑中和反应,需NaOH 2 mol,生成2molH2O和2mol![]() ,2mol
,2mol![]() 与1molCa2+反应生成1molCaCO3沉淀,离子方程式为:Ca2++2
与1molCa2+反应生成1molCaCO3沉淀,离子方程式为:Ca2++2![]() +2OH-====CaCO3↓+2H2O+
+2OH-====CaCO3↓+2H2O+![]() 。依次类推:NaOH溶液中加入足量Ca(HCO3)2时:OH-+Ca2++
。依次类推:NaOH溶液中加入足量Ca(HCO3)2时:OH-+Ca2++![]() ====H2O+CaCO3↓
====H2O+CaCO3↓
(2)明矾KAl(SO4)2电离方程式:KAl(SO4)2====K++Al3++2![]() ,加入Ba(OH)2时,反应的实质是Al3+与OH-反应,Ba2+与
,加入Ba(OH)2时,反应的实质是Al3+与OH-反应,Ba2+与![]() 的反应,Al3+与OH-的物质的量之比是书写离子方程式的关键,当Al3+全部沉淀时:n(Al3+):n(OH-)=1∶3,若消耗KAl(SO4)2为1mol,则消耗Ba(OH)2为1.5mol。当沉淀全部溶解时:n(Al3+)∶n(OH-)=1∶4,若消耗KAl(SO4)21mol,则消耗Ba(OH)22mol。
的反应,Al3+与OH-的物质的量之比是书写离子方程式的关键,当Al3+全部沉淀时:n(Al3+):n(OH-)=1∶3,若消耗KAl(SO4)2为1mol,则消耗Ba(OH)2为1.5mol。当沉淀全部溶解时:n(Al3+)∶n(OH-)=1∶4,若消耗KAl(SO4)21mol,则消耗Ba(OH)22mol。
答案:(1)Ca2++2![]() +2OH-====CaCO3↓+2H2O+
+2OH-====CaCO3↓+2H2O+![]() ;
;
OH-+Ca2++![]() ====H2O+CaCO3↓。
====H2O+CaCO3↓。
(2)Al3+全部沉淀时:2Al3++3![]() +6OH-+3Ba2+====Al(OH)3↓+3BaSO4↓
+6OH-+3Ba2+====Al(OH)3↓+3BaSO4↓
Al(OH)3全部溶解时:Al3++2![]() +4OH-+2Ba2+====
+4OH-+2Ba2+====![]() +2H2O+2BaSO4↓
+2H2O+2BaSO4↓

 、NO
、NO 、SO
、SO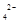 、Na
、Na
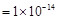 mol/L的溶液中:Ca
mol/L的溶液中:Ca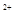 、K
、K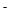 、HCO
、HCO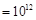 的溶液中:NH
的溶液中:NH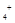 、Al
、Al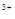 、NO
、NO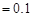 mol/L的溶液中:K
mol/L的溶液中:K