题目内容
将Mg、Cu组成的2.64g混合物投入适量稀稍酸中恰好完全反应,并收集还原产物气体NO(还原产物只有一种)。然后向反应后的溶液中加入一定浓度的氢氧化钠溶液,使金属恰好沉淀完全,此时生成沉淀的质量为4.68g,则反应过程中收集到NO气体(标况下)体积为 ( )
| A.8.96L | B.4.48L | C.0.896L | D.0.448L |
C
试题分析:根据题意可知金属的质量为2.64g,金属氢氧化物的质量为4.68g,可求出OH-的质量为2.04g,金属失1mol电子就结合1molOH-,因此OH-的量就是失电子的量,所以反应中失电子
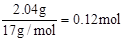 ,1molNO生成得3mol电子,根据得失电子数相等可求得NO的量为0.04mol,所以标准状况下,NO的体积为0.896L。答案选C。
,1molNO生成得3mol电子,根据得失电子数相等可求得NO的量为0.04mol,所以标准状况下,NO的体积为0.896L。答案选C。点评:本题的关键就是找到金属结合OH-的量与转移电子数的关系。

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目

 mol
mol