题目内容
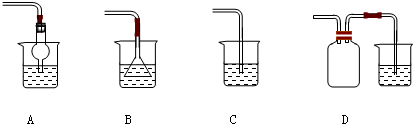
在粗盐提纯实验中,下列操作正确的是( )
分析:A、在过滤时,不能用玻璃棒在漏斗中进行搅拌,防止弄坏滤纸;
B、过滤时,漏斗中液体的液面应低于滤纸边缘;
C、蒸发时,有晶体析出后仍用玻璃棒搅拌,防止液体局部受热;
D、蒸发皿中出现多量固体时,就停止加热,利用余热蒸干晶体.
B、过滤时,漏斗中液体的液面应低于滤纸边缘;
C、蒸发时,有晶体析出后仍用玻璃棒搅拌,防止液体局部受热;
D、蒸发皿中出现多量固体时,就停止加热,利用余热蒸干晶体.
解答:解:A、在过滤时,不能用玻璃棒在漏斗中进行搅拌,防止弄坏滤纸,故A错误;
B、过滤时,漏斗中液体的液面应低于滤纸边缘,故B正确;
C、蒸发时,有晶体析出后仍用玻璃棒搅拌,防止液体局部受热,故C错误;
D、蒸发皿中出现多量固体时,就停止加热,利用余热蒸干晶体,故D错误;
故选B.
B、过滤时,漏斗中液体的液面应低于滤纸边缘,故B正确;
C、蒸发时,有晶体析出后仍用玻璃棒搅拌,防止液体局部受热,故C错误;
D、蒸发皿中出现多量固体时,就停止加热,利用余热蒸干晶体,故D错误;
故选B.
点评:本题主要考查了过滤操作注意事项,难度不大,根据课本知识即可完成.

练习册系列答案
相关题目