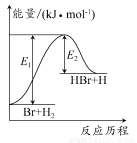
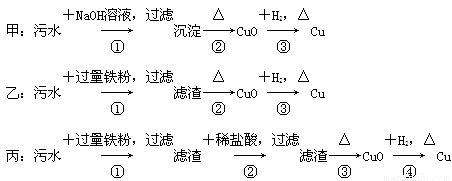
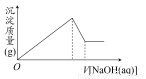
题目内容
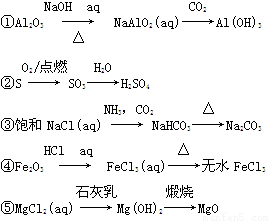
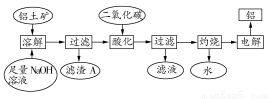
铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程:
已知:
(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为:2Na2SiO3+2NaAlO2+2H2O=Na2Al2Si2O8↓+4NaOH
回答下列问题:
(1)写出向铝土矿中加入足量氢氧化钠溶液后,该步操作中发生反应的离子方程式: 。
(2)滤渣A的主要成分为 ;滤渣A的用途是 (只写一种);实验室过滤时使用玻璃棒,其作用是 。
(3)在工艺流程第三步中,选用二氧化碳作酸化剂的原因是 。
(4)若将铝溶解,下列试剂中最好选用 (填编号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸
理由是 。
(1)Al2O3+2OH-=2AlO2-+H2O SiO2+2OH-=SiO32-+H2O
(2)Fe2O3、Na2Al2Si2O8 炼铁的原料(或生产硅酸盐产品的原料) 引流
(3)经过足量氢氧化钠溶液的溶解,大部分铝元素均以NaAlO2的形式存在于滤液中,通入过量二氧化碳可以将NaAlO2完全转化为Al(OH)3
(4)B 铝与浓硫酸在常温下发生钝化,加热溶解会产生有毒气体SO2,原料利用率低;稀硝酸能溶解铝但会产生NO气体,污染空气,硝酸利用率低;而铝与稀硫酸反应速率较快,产生的H2对空气无污染。
【解析】(1)Al2O3属于两性氧化物,SiO2属于酸性氧化物,都能与强碱反应。
(2)利用题目给出的信息——“硅铝酸盐沉淀”,可以知道滤渣A的主要成分是Fe2O3、Na2Al2Si2O8。对于滤渣A的用途一般很容易想到其可以作为炼铁的原料。
(3)因为Al(OH)3是两性氢氧化物,若用强酸酸化滤液时,无法保证将全部铝元素转化为Al(OH)3过滤出来。
(4)分析问题时,一般要同时考虑生产效益(原料利用率)和环保问题。