题目内容
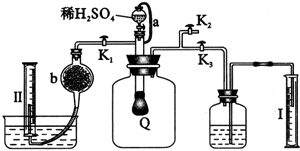
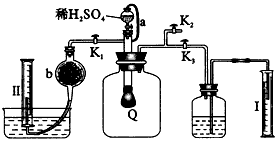
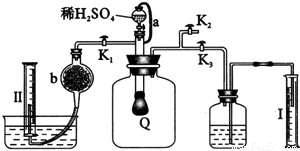
为测定已变质的过氧化钠(含碳酸钠)的纯度,设计如图所示实验:Q为一具有良好弹性的气球,称取一定量的样品放于其中,按图组装实验装置,打开分液漏斗的活塞,将稀H2SO4滴入气球中.
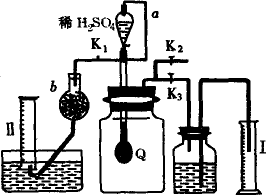
(1)Q内发生反应后生成________种气体,其中的反应有________个属于氧化还原反应.
(2)为测出反应时生成气体的总体积,滴稀H2SO4前必须关闭________(填“K1”、“K2”或“K3”,下同),打开________.
(3)当上述反应停止后,将K1、K2、K3处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是________.
(4)导管a的作用是________.
(5)b中装的固体试剂是________,为何要缓缓打开K1;________.
(6)实验结束时,量筒Ⅰ中有x mL水,量筒Ⅱ中收集到y mL气体,则过氧化钠的纯度是________(上述体积均已折算为标准状况).
解析:
|
本题通过实验测定气体的体积来计算已变质Na2O2的纯度,从而考查了学生的实验能力.其解题思路为: (1)由于Na2O2中混有Na2CO3,所以将稀H2SO4滴入混合物中后发生了两个反应:①2Na2O2+2H2SO4 (2)要测定反应时生成气体的总体积,必须用排水法,然后测量所排出的水的体积来计算放出的气体总体积.因此,反应前应先把K1和K2关闭,打开K3. (3)打开K2的目的是平衡广口瓶内外的压强,让气球Q的气体顺利通过K1、b.在Ⅱ中用排水法收集反应生成的O2,当打开K1时可看到气球Q慢慢缩小. (4)由于滴入稀H2SO4后与固体反应放出气体,使气球Q的压强过大,稀H2SO4不能继续顺利滴下,所以导管a的作用是平衡分液漏斗上、下的压强,使稀H2SO4顺利滴下. (5)Ⅱ中主要收集反应放出的O2,而O2中混有CO2必须除去,除去CO2所用固体试剂应为碱石灰.为使CO2除得比较彻底必须让碱石灰充分吸收,因此控制气体的流速是关键的步骤,故K1要缓缓打开. (6)实验结束后,很显然量筒Ⅰ中水的体积是固体混合物与稀H2SO4反应放出的气体(CO2、O2)排出水的体积,而量筒Ⅱ中的气体是O2.因此Na2O2的纯度为:
|

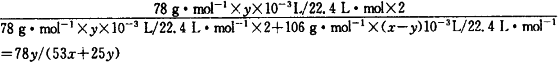
 为测定已变质的过氧化钠的纯度,设计如下图所示的实验;Q为一具有良好的弹性气球,称取一定量的样品放于其中,按图安装的实验装置打开分液漏斗的活塞,将稀H2SO4滴入气球中.请填空:
为测定已变质的过氧化钠的纯度,设计如下图所示的实验;Q为一具有良好的弹性气球,称取一定量的样品放于其中,按图安装的实验装置打开分液漏斗的活塞,将稀H2SO4滴入气球中.请填空: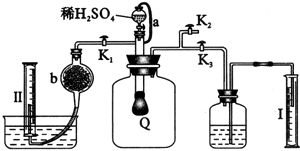 为测定已变质的过氧化钠的纯度,设计如下图所示的实验;Q为一具有良好的弹性气球,称取一定量的样品放于其中,按图安装的实验装置打开分液漏斗的活塞,将稀H2SO4滴入气球中.请填空:
为测定已变质的过氧化钠的纯度,设计如下图所示的实验;Q为一具有良好的弹性气球,称取一定量的样品放于其中,按图安装的实验装置打开分液漏斗的活塞,将稀H2SO4滴入气球中.请填空: