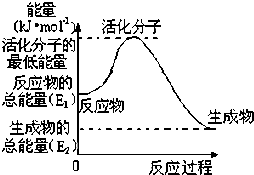
题目内容
16.写出下列反应的热化学方程式.(1)已知拆开1mol H-H键,1mol N-H键,1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1
(2)已知:2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol
Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226KJ/mol
请写出常温下,过氧化钠与一氧化碳反应生成碳酸钠的热化学方程式:CO(g)+Na2O2(s)=Na2CO3(s)△H=-549 kJ/mol.
分析 (1)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
(2)依据热化学方程式和盖斯定律计算构造所需热化学方程式得到反应的焓变,由盖斯定律:$\frac{1}{2}$×①+②得CO(g)+Na2O2(s)=Na2CO3(s).
解答 解:(1)在反应N2+3H2?2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1;
(2)已知①2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
②Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-266kJ/mol,
由盖斯定律:$\frac{1}{2}$×①+②得CO(g)+Na2O2(s)=Na2CO3(s)△H=$\frac{1}{2}$×(-566)+(-266)=-549 kJ/mol,
故答案为:CO(g)+Na2O2(s)=Na2CO3(s)△H=-549 kJ/mol.
点评 本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.同时还考查了反应热的计算,题目难度不大,注意把握从键能的角度计算反应热的方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.已知0.1mol/L的CH3COOH(aq)中存在电离平衡:CH3COOH?CH3COO-+H+ 要使溶液c(H+):c (CH3COOH) 可能变大,可以使用的方法是( )
| A. | 加入少量NaOH(s) | B. | 加入CH3COONa(s) | C. | 加入少量冰醋酸 | D. | 不断加入食盐水 |
11.下列关于热化学反应的描述中正确的是( )
| A. | HCl和NaOH反应的中和热△H=-57.3kJ•mol-1,则1mol H2SO4和足量氨水反应,释放的热量为114.6kJ | |
| B. | 已知在1×105Pa、298K条件下,2mol氢气燃烧生成水蒸气,放出484 kJ热量,则有:H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242kJ/mol | |
| C. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是:CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ•mol-1,则CH3OH(g)的燃烧热为192.9kJ•mol-1 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
8.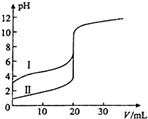 室温下,用0.100mol•L-1 NaOH溶液分别滴定20.00ml 0.100mol•L-1 的盐酸和醋酸,滴定曲线如图所示,下列说法不正确的是( )
室温下,用0.100mol•L-1 NaOH溶液分别滴定20.00ml 0.100mol•L-1 的盐酸和醋酸,滴定曲线如图所示,下列说法不正确的是( )
 室温下,用0.100mol•L-1 NaOH溶液分别滴定20.00ml 0.100mol•L-1 的盐酸和醋酸,滴定曲线如图所示,下列说法不正确的是( )
室温下,用0.100mol•L-1 NaOH溶液分别滴定20.00ml 0.100mol•L-1 的盐酸和醋酸,滴定曲线如图所示,下列说法不正确的是( )| A. | Ⅱ表示的是滴定盐酸的曲线 | |
| B. | PH=7时,滴定盐酸消耗V(NaOH)大于滴定醋酸消耗V(NaOH) | |
| C. | V(NaOH)=20ml时,C(Cl-)═C(CH3COO-) | |
| D. | V(NaOH)=10ml时,醋酸溶液中:C(CH3COO- )>C(Na+ )>C(H+)>C(OH-) |
6.在同一容器内有X、Y、Z、Q四种物质,在合适的条件下反应,反应前后各物质的质量如下表,该反应一定属于( )
| X | Y | Z | Q | |
| 反应前g | 20 | 20 | 20 | 205 |
| 反应后g | 10 | 20 | 26 | 24 |
| A. | 氧化还原反应 | B. | 分解反应 | C. | 离子反应 | D. | 复分解反应 |