题目内容
【题目】某小组进行“铁与水蒸气”反应的产物及其性质探究系列实验。请回答实验中的问题:

(1)写出该反应的化学方程式__________,若16.8g铁粉参加反应,转移电子数目为_____。
(2)待试管冷却后,取少许其中的固体物质溶于稀盐酸得溶液A,取所得液滴加KSCN溶液,溶液无颜色变化,说明硬质试管中固体物质的成分是_______ 溶液未变红色的原因是___________(用离子方程式表示)。
(3)若要使(2)中所得溶液变红又不增加溶液离子种类,可以加入适量____试剂。
(4)另取(2)中溶液A,加入NaOH溶液,观察到生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色。沉淀转化过程发生的反应方程式为______________。
(5)某催化剂(主要成分FeO、Fe2O3)中+2价铁与+3价铁的物质的量之比为1:2时,其催化活性最高,此时铁的氧化物的混合物中铁的质量分数为________(用小数表示,保留两位小数)。
【答案】 3Fe+4H2O(g)![]() Fe3O4+4H2 0.8NA Fe、Fe3O4 2Fe3+ + Fe =3Fe2+ 氯水或Cl2 4Fe(OH)2+2H2O+O2 = 4Fe(OH)3 0.72
Fe3O4+4H2 0.8NA Fe、Fe3O4 2Fe3+ + Fe =3Fe2+ 氯水或Cl2 4Fe(OH)2+2H2O+O2 = 4Fe(OH)3 0.72
【解析】(1)铁与水蒸气反应的化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2,16.8g铁粉的物质的量为
Fe3O4+4H2,16.8g铁粉的物质的量为![]() =0.3mol,根据方程式生成0.4mol氢气,转移电子数目为0.8NA,故答案为:3Fe+4H2O(g)
=0.3mol,根据方程式生成0.4mol氢气,转移电子数目为0.8NA,故答案为:3Fe+4H2O(g)![]() Fe3O4+4H2;0.8NA;
Fe3O4+4H2;0.8NA;
(2)待试管冷却后,取少许其中的固体物质溶于稀盐酸得溶液A,溶液A中加KSCN溶液,溶液无颜色变化,反应生成的四氧化三铁溶解后生成的铁离子被铁还原,生成亚铁离子,溶液中不存在铁离子,因此溶液未变红色,说明硬质试管中固体物质为Fe、Fe3O4,故答案为:Fe、Fe3O4;2Fe3+ + Fe =3Fe2+;
(3)氯气能够将亚铁离子氧化为铁离子,因此通入氯气溶液将变红且不增加溶液中离子种类,故答案为:氯水或Cl2;
(4)另取(2)中溶液A,加入NaOH溶液,观察到生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色,是生成的氢氧化亚铁被空气中的氧气氧化的结果,故答案为:4Fe(OH)2+2H2O+O2 = 4Fe(OH)3;
(5)因催化剂中Fe2+与Fe3+的物质的量之比为1:2,所以FeO、Fe2O3的物质的量之比为1:1,设此时混合物中FeO的质量为72n,Fe2O3的质量为160n,混合物的质量为232n,混合物中铁的质量分数=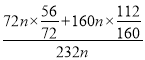 ×100%=72%=0.72,故答案为:0.72。
×100%=72%=0.72,故答案为:0.72。

