题目内容
(8分)已知由短周期元素组成的A、B、C、D四种化合物所含原子数目依次为2、3、4、5,其中A、B、C含有18个电子,D含有10个电子。请回答
(1)A、B、D的化学式分别是A ;B ;D
(2)已知8gD与O2完全反应,生成稳定化合物时放出445kJ的热量,写出反应的热化学方程式
(3)若C为第一和第二周期元素组成的化合物。①C的溶液中加入少量的二氧化锰,有无色气体生成,写出化学方程式
②C的溶液中加入足量二氧化锰和稀硫酸,二氧化锰逐渐溶解生成Mn2+,反应中二氧化锰做 剂
③当C分别发生①和②两个反应时,若都有1molC完全反应,①和②两个反应中转移电子数之比是:
(1)HCl; H2S; CH4
(2)CH4(g)+2O2(g)==CO2(g)+2H2O(l);△H=-890KJ.mol-1
(3) ①2H2O2== 2H2O+ O2↑ ②氧化剂 ③1:2
【解析】
试题分析:(1)由短周期两原子组成的18电子的化合物为HCl,三原子组成的18电子的化合物为H2S,四原子组成的18电子化合物为PH3或H2O2,由短周期五原子组成的10电子的化合物为CH4;(2)根据题意1molCH4完全燃烧放出热量为:△H=-890kJ·mol-1,则其反应的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l); △H=-890kJ·mol-1;(3)若C为第一和第三周期元素组成的化合物,则C为PH3,根据题意,为PH3在氧气中燃烧生成两种氧化物即为P2O5、H2O,反应方程式为:2PH3+4O2 P2O5+3H2O;若C为第一和第二周期元素组成的化合物,则C为H2O2,H2O2在二氧化锰作用下会迅速产生氧气:2H2O2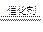 2H2O+O2↑;H2O2溶液中加入足量二氧化锰和稀硫酸,二氧化锰逐渐溶解生成Mn2+,锰元素化合价降低,二氧化锰做氧化剂;2H2O2
2H2O+O2↑;H2O2溶液中加入足量二氧化锰和稀硫酸,二氧化锰逐渐溶解生成Mn2+,锰元素化合价降低,二氧化锰做氧化剂;2H2O2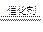 2H2O+O2↑1molH2O2完全反应,转移电子1mol,H2O2+MnO2+H2SO4=MnSO4+2H2O+O2↑,1molH2O2完全反应,转移电子2mol,两个反应中转移电子数之比是1:2。
2H2O+O2↑1molH2O2完全反应,转移电子1mol,H2O2+MnO2+H2SO4=MnSO4+2H2O+O2↑,1molH2O2完全反应,转移电子2mol,两个反应中转移电子数之比是1:2。
考点:原子结构元素周期律
点评:解题关键是掌握前20号元素原子结构



