题目内容
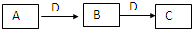
在一定条件下进行下列化学反应,请根据以下的转化关系回答下列问题,已知A、B、C中均含有同一种元素.已知:

①若D为金属单质,且以上反应均为氧化还原反应,请写出检验B中阳离子的一种方法
②若D为碱,且以上反应均为非氧化还原反应,则A、B、C、D分别可以是:(按顺序写出合理的一组物质的化学式即可)A
③D为碱时,写出A和C反应的离子方程式

①若D为金属单质,且以上反应均为氧化还原反应,请写出检验B中阳离子的一种方法
向其溶液中滴加NaOH溶液,出现白色沉淀,迅速变为灰绿色,最后变为红褐色,则其溶液中有Fe2+;
向其溶液中滴加NaOH溶液,出现白色沉淀,迅速变为灰绿色,最后变为红褐色,则其溶液中有Fe2+;
.②若D为碱,且以上反应均为非氧化还原反应,则A、B、C、D分别可以是:(按顺序写出合理的一组物质的化学式即可)A
AlCl3
AlCl3
,BAl(OH)3
Al(OH)3
,CNaAlO2
NaAlO2
,DNaOH
NaOH
.③D为碱时,写出A和C反应的离子方程式
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.分析:A、B、C中均含有同一种元素,且ABC和同种物质连续发生反应,化学上能实现此转化的物质较多,可以是氧化还原反应,也可以是酸碱反应,最主要的是A和C能生成B的转化分析和判断;
若D为金属,则ABC 中的元素化合价要变化,实现转化是氧化还原反应;变价金属典型的是铁元素,转化关系只能是Fe3+→Fe2+→Fe,能实现三价铁离子变为二价铁离子的金属,并且能从二价铁盐溶液中置换出金属铁的金属只有锌,所以判断D为锌;若D为碱,反应均为非氧化还原反应,元素化合物中能与强碱连续反应的典型物质是铝及其化合物的性质,即Al3+→Al(OH)3→AlO2-;符合题中的转化关系,结合物质的性质分析解答;
若D为金属,则ABC 中的元素化合价要变化,实现转化是氧化还原反应;变价金属典型的是铁元素,转化关系只能是Fe3+→Fe2+→Fe,能实现三价铁离子变为二价铁离子的金属,并且能从二价铁盐溶液中置换出金属铁的金属只有锌,所以判断D为锌;若D为碱,反应均为非氧化还原反应,元素化合物中能与强碱连续反应的典型物质是铝及其化合物的性质,即Al3+→Al(OH)3→AlO2-;符合题中的转化关系,结合物质的性质分析解答;
解答:解:根据题给反应关,系,①若D为金属单质,则可以是锌,A可以是FeCl3,锌适量时,Zn+2FeCl3=ZnCl2+2FeCl2;锌过量时,Zn+FeCl2=ZnCl2+Fe,且Fe+2FeCl3=3FeCl2符合题意,所以B为FeCl2,检验B中金属离子的方法是:向其溶液中滴加NaOH溶液,出现白色沉淀,迅速变为灰绿色,最后变为红褐色,则其溶液中有Fe2+;
故答案为:向其溶液中滴加NaOH溶液,出现白色沉淀,迅速变为灰绿色,最后变为红褐色,则其溶液中有Fe2+;(或向其溶液中加入硫氰酸钾溶液,无变化,加入氯水变红证明二价铁离子的存在)
②若D为碱,且以上反应均为非氧化还原反应,所以与碱能发生连续反应的最典型的物质是Al3+,则A可以是AlCl3,B是Al(OH)3,C是NaAlO2,D为NaOH;故答案为:A是AlCl3,B是Al(OH)3,C是NaAlO2,D为NaOH;
③D为碱时,A和C反应是氯化铝和偏铝酸钠反应生成氢氧化铝沉淀,所以反应的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓;故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
故答案为:向其溶液中滴加NaOH溶液,出现白色沉淀,迅速变为灰绿色,最后变为红褐色,则其溶液中有Fe2+;(或向其溶液中加入硫氰酸钾溶液,无变化,加入氯水变红证明二价铁离子的存在)
②若D为碱,且以上反应均为非氧化还原反应,所以与碱能发生连续反应的最典型的物质是Al3+,则A可以是AlCl3,B是Al(OH)3,C是NaAlO2,D为NaOH;故答案为:A是AlCl3,B是Al(OH)3,C是NaAlO2,D为NaOH;
③D为碱时,A和C反应是氯化铝和偏铝酸钠反应生成氢氧化铝沉淀,所以反应的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓;故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
点评:本题考查了元素化合物的化学性质的应用,特别是能和一种物质发生连续反应的实质,连续反应的特征和转化关系中A+B→C的转化判断是解决本题的关键,综合性较强,需要熟练掌握元素化合物的有关知识.

练习册系列答案
相关题目
 在一定条件下进行下列化学反应,请根据以下的转化关系回答下列问题,已知A、B、C中均含有同一种元素,D为非金属单质,能使带有火星的木条复燃.
在一定条件下进行下列化学反应,请根据以下的转化关系回答下列问题,已知A、B、C中均含有同一种元素,D为非金属单质,能使带有火星的木条复燃. 2SO3(g);△H=-197kJ/mol,当放出315.2kJ热量时,SO2的转化率为
2SO3(g);△H=-197kJ/mol,当放出315.2kJ热量时,SO2的转化率为