题目内容
17.现有一定温度下的密闭容器中存在如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),知CO和H2O的起始浓度均为2mol/L经测定该反应在该温度下的平衡常数K=2.60,试判断,(1)当CO转化率为25%时,该反应是否达到平衡状态,若未达到,哪个方向进行?
(2)达平衡状态时,CO的转化率应为多少?
(3)当CO的起始浓度仍为2mol/L,H2O的起始浓度为6mol/L时,平衡时CO的转化率为多少?
分析 (1)当CO转化率为25%时,CO浓度变化量为0.5mol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
初始浓度(mol/L):2 2 0 0
变化浓度(mol/L):0.5 0.5 0.5 0.5
CO转化率为25%时浓度(mol/L):1.5 1.5 0.5 0.5
计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行;
(2)设平衡时CO的转化率为x,表示出平衡时各组分浓度,利用平衡常数列方程计算解答;
(3)设平衡时CO的转化率为a,表示出平衡时各组分浓度,利用平衡常数列方程计算解答.
解答 解:(1)当CO转化率为25%时,CO浓度变化量为0.5mol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
初始浓度(mol/L):2 2 0 0
变化浓度(mol/L):0.5 0.5 0.5 0.5
CO转化率为25%时浓度(mol/L):1.5 1.5 0.5 0.5
此时浓度商Qc=$\frac{0.5×0.5}{1.5×1.5}$=$\frac{1}{9}$<K=2.6,未到达平衡状态,反应向正反应进行,
答:未到达平衡状态,反应向正反应进行.
(2)设平衡时CO的转化率为x,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
初始浓度(mol/L):2 2 0 0
变化浓度(mol/L):2x 2x 2x 2x
平衡浓度(mol/L):2-2x 2-2x 2x 2x
所以$\frac{2x×2x}{(2-2x)×(2-2x)}$=2.6,解得x=61.7%,
答:平衡时CO的转化率为61.7%;
(3)设平衡时CO的转化率为a,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
初始浓度(mol/L):2 6 0 0
变化浓度(mol/L):2a 2a 2a 2a
平衡浓度(mol/L):2-2a 6-2a 2a 2a
所以$\frac{2a×2a}{(2-2a)×(6-2a)}$=2.6,解得a=86.5%,
答:平衡时CO的转化率为86.5%.
点评 本题考查化学平衡计算,涉及平衡常数有关计算,计算量较大,属于易错题目,注意理解掌握平衡常数的应用.

 阅读快车系列答案
阅读快车系列答案| A. | CuCl2 | B. | NaHSO4 | C. | NaHCO3 | D. | SO2 |
| A. | 无色 | B. | 难溶于水 | ||
| C. | 无毒 | D. | 相同条件下密度比空气大 |
| A. | 蒸馏水 氨水 氧化铝 二氧化硫 | |
| B. | 盐酸 空气 硫酸 干冰 | |
| C. | 胆矾 盐酸 铁 碳酸钙 | |
| D. | 生石灰 硫酸 氯化铜 碳酸钠 |
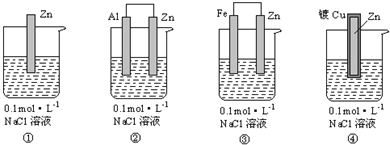
| A. | ③①②④ | B. | ④②①③ | C. | ①③②④ | D. | ④①②③ |
| A. | CH3CH3+Cl2 $\stackrel{光照}{→}$ CH2=CH2+2HCl | |
| B. | CH2=CH2+Br2→CH3CHBr2 | |
| C. | CH3CH2OH+O2$→_{△}^{Cu}$CH3CHO+H2O | |
| D. | CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O |
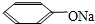 ;
;