题目内容
【题目】(1)科学家常用量热计来直接测定某一反应的反应热,现测得:CH3OH(g)+ 3/2O2(g)=CO2(g)+2H2O(g)△H=-192.9kJ/mol,又知H2O(l)=H2O(g)△H=+44kJ/mol,请写出32g CH3OH(g)完全燃烧生成液态水的热化学方程式 ________________________________________________
(2)已知C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol, 2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ/mol,C(s)+0.5O2(g)=CO(g) △H3=akJ/mol,则a=__________
(3)已知N2(g) +3H2(g) ![]() 2NH3(g)1,0.5 N2(g)+1.5H2(g)
2NH3(g)1,0.5 N2(g)+1.5H2(g) ![]() NH3(g) ,NH3(g)
NH3(g) ,NH3(g) ![]() 0.5 N2(g)+1.5H2(g) 的平衡常数分别为k1,K2,K3,写出K1和K2的关系式_______,写出K2和K3的关系式________
0.5 N2(g)+1.5H2(g) 的平衡常数分别为k1,K2,K3,写出K1和K2的关系式_______,写出K2和K3的关系式________
【答案】 CH3OH(g)+ 3/2O2(g)=CO2(g)+2H2O(l)△H=-280.9kJ/mol -110.5 K1=K22 K2· K3=1
【解析】本题主要考查关于反应热的计算。
(1)32g即1molCH3OH(g)完全燃烧生成液态水的热化学方程式为CH3OH(g)+ 3/2O2(g)=CO2(g)+2H2O(l)△H=(-192.9-88)kJ=-280.9kJ/mol。
(2)△H3=akJ/mol=△H1-0.5△H2,则a=-110.5。
(3)从平衡常数的表达式可以得出K1和K2的关系式为K1=K22,K2和K3的关系式为K2K3=1。

 名校课堂系列答案
名校课堂系列答案【题目】在证明海带中存在碘元素的实验操作中,主要仪器选用错误的是
选选项 | 操作 | 主要仪器 |
A | 称取3.0 g干海带 | 托盘天平 |
B | 灼烧干海带至完全变成灰烬 | 烧杯 |
C | 过滤煮沸后的海带灰与水的混合液 | 漏斗 |
D | 用四氯化碳从氧化后的海带灰浸取液中提取碘 | 分液漏斗 |
A. A B. B C. C D. D
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | C | N | O | F | ||||
3 | Na | Mg | Al | S | Cl | Ar |
(1)非金属性最强的元素是 ;
(2)化学性质最不活泼的单质是 ;
(3)C和O中,原子半径较大的是 ;
(4)某离子的结构示意图为![]() ,该离子的符号为__________;
,该离子的符号为__________;
(5)硫有两种重要氧化物,分别为SO2和 (填化学式);
(6)H2S和HCl中,热稳定性较强的是 ;
(7)NaOH、Mg(OH)2、Al(OH)3中,碱性最强的是 ;属于两性氢氧化物的是 ;
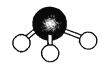
(8)氮的一种气态氢化物的分子球棍模型如图所示,写出它的化学式 ,其水溶液显 (填“酸性”或“碱性”),此氢化物中N元素和H元素的质量比m(N)∶m(H)= ;
(相对原子质量:N一14 H—1)