题目内容
【题目】常温下,用0.05molL﹣1 KOH溶液滴定 10.00mL0.05molL﹣1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(体积变化忽略不计).下列说法正确的是( )
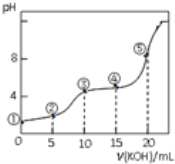
A.点②溶液中:c(K+)+c(H+)=c(HC2O4﹣)+c(C2O42﹣)+c(OH﹣)
B.点③溶液中:c(K+)=c(HC2O4﹣)+c(C2O42﹣)+2c(H2C2O4)
C.点④溶液中:c(K+)+c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣)=0.05 molL﹣1
D.点⑤溶液中:c(K+)>c(HC2O4﹣)>c(C2O42﹣)>c(OH﹣)>c(H+)
【答案】C
【解析】
试题分析:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(K + ) + c(H + ) = c(HC2O4﹣) + 2c(C2O42﹣) + c(OH﹣),A错误;B.二者恰好完全反应生成KHC2O4,该点溶液中溶质为任何电解质溶液中都存在物料守恒,根据物料守恒得c(K + ) = c(HC2O4﹣) + c(C2O42﹣) + c(H2C2O4),B错误;C.点④溶液中存在等物质的量浓度的K2C2O4和KHC2O4,由物料守恒可知,c(K + ) + c(H2C2O4) + c(HC2O4﹣) + c(C2O42﹣) = 0.05 mol/L × (0.015 + 0.01)L/(0.015 + 0.01)L = 0.05 molL-1,C正确;D.该点溶液中二者恰好完全反应,溶液中溶质为K2C2O4,草酸根离子水解导致溶液呈碱性,但其水解程度较小,所以c(HC2O4-) < c(C2O42-),D错误;答案选AD。

练习册系列答案
相关题目