题目内容
已知X、M、N为周期表中1~20号元素,
(1)X的最高正化合价与最低负化合价的代数和为4,且X在最高价氧化物中的质量分数为40%,则X在周期表中的位置是________________________.
(2)4.5 g金属单质M与足量的稀硫酸溶液完全反应放出氢气,电子转移的个数为3.01×1023,则该金属M是________;
(3)N元素的同位素AZN,它的氯化物NCl2 2.22 g溶于水制成溶液后,加入2 mol·L-1的AgNO3溶液20 mL,恰好完全反应.若这种同位素原子核内有20个中子,则Z=________.
答案:(1)第三周期第ⅥA族;(2)铝(Al);(3)20

练习册系列答案
相关题目
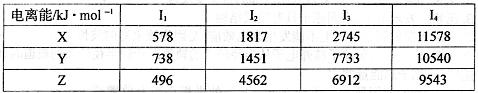
(1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如表:
则X、Y、Z的电负性从大到小的顺序为 (用元素符号表示),元素Y的第一电离能大于X的第一电离能原因是 .
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取SP3杂化.
①A、B、C的第一电离能由小到大的顺序为 (用元素符号表示).
②M是含有 键的 分子(填“极性”或“非极性”)
③N是一种易液化的气体,请简述其易液化的原因 .
④W分子的VSEPR模型的空间构型为 ,W分子的空间构型为 .
⑤AB-离子中和B2分子的π键数目比为 .
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4S1.
①E元素组成的单质的晶体堆积模型为 (填代号)
a.简单立方堆积 b.体心立方堆积 c.六方最密堆积 d.面心立方最密堆积
②F元素在其化合物中最高化合价为 .
③G2+离子的核外电子排布式为 ,G2+和N分子形成的配离子的结构式为 .
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2754 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取SP3杂化.
①A、B、C的第一电离能由小到大的顺序为
②M是含有
③N是一种易液化的气体,请简述其易液化的原因
④W分子的VSEPR模型的空间构型为
⑤AB-离子中和B2分子的π键数目比为
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4S1.
①E元素组成的单质的晶体堆积模型为
a.简单立方堆积 b.体心立方堆积 c.六方最密堆积 d.面心立方最密堆积
②F元素在其化合物中最高化合价为
③G2+离子的核外电子排布式为
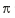 键数目比为_______________。
键数目比为_______________。
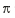 键数目比为_______________。
键数目比为_______________。