题目内容
氧化还原反应在生产、生活中具有广泛的用途。下列做法中涉及到铝元素的还原性的是( )
A.明矾净化水
B.用氢氧化铝治疗胃酸过多
C.用铝制容器存放浓硫酸
D.电解熔融氧化铝制单质铝
C
【解析】A项是:Al3++3H2O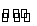 Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮杂质而起到净化水的作用;B项是:Al(OH)3+3HCl=AlCl3+3H2O;D项是:电解时铝从化合物中被还原得到铝单质,表现出氧化性;而C项铝被浓硫酸氧化,表现出还原性,故选C项。
Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮杂质而起到净化水的作用;B项是:Al(OH)3+3HCl=AlCl3+3H2O;D项是:电解时铝从化合物中被还原得到铝单质,表现出氧化性;而C项铝被浓硫酸氧化,表现出还原性,故选C项。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目



