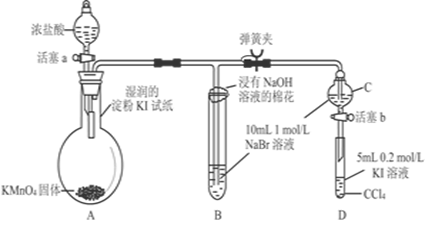
题目内容
25 ℃、101 kPa下,①2Na (s)+1/2 O2(g)="==" Na2O(s) ΔH 1 =-414 kJ/mol
②2Na (s)+O2(g)===Na2O2(s) ΔH2=-511 kJ/mol,下列说法正确的是( )
| A.①和②产物的阴阳离子个数比不相等 |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D.25 ℃、101 kPa下,Na2O2(s)+2Na(s)===2Na2O(s) ΔH=-317 kJ/mol |
D
解析试题分析:A、在Na2O中阳离子是钠离子、阴离子是氧离子,Na2O2中阳离子是钠离子、阴离子是过氧根离子,因此阴、阳离子的个数比都是1:2,错误;B、由钠原子守恒可知,①和②生成等物质的量的产物时,钠元素的化合价都是由0升高到+1价,则转移的电子数相同,错误;C、温度升高,Na与足量O2反应的产物是Na2O2,错误;D、热化学方程式25℃、101kPa下:①2Na(s)+1/2O2(g)=Na2O(s)△H=-414kJ?mol-1,②2Na(s)+O2(g)=Na2O2(s)△H=-511kJ?mol-1,①×2-②可得Na2O2(s)+2Na(s)=2Na2O(s)△H=-317kJ?mol-1,正确.
考点:本题考查物质结构与性质、电子转移、热化学方程式的书写。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案海水提镁的主要流程如下: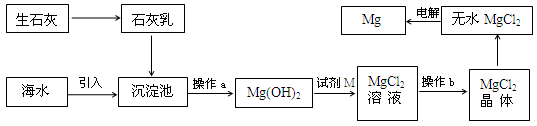
下列说法正确的是
①试剂M是盐酸 ②流程中的反应全部都是非氧化还原反应
③操作b只是过滤 ④用海水晒盐后的饱和溶液加石灰乳制Mg(OH)2
⑤电解熔融MgCl2比电解熔融的MgO制金属镁更节约能量
| A.①②③④⑤ | B.②③ | C.④⑤ | D.①④⑤ |
某温度下,w克某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的Na2O2反应,固体质量增加w克。在①H2 、②CO、 ③CO和H2的混合气、④C6H12O6中( )
| A.均不符合 | B.只有①② | C.只有①②③ | D.全部符合 |
镁、铝混合粉末10.2g,将它溶于500mL4mol/L的盐酸里,若要使沉淀质量达到最大值,则需加入2mol·l-1的氢氧化钠溶液的体积为
| A.1000mL | B.500mL | C.100mL | D.1500mL |
下列根据实验事实得出的结论正确的是
| | 实 验 事 实 | 结 论 |
| A | 加热的铝箔熔化,但液态的铝不滴落 | 熔点:氧化铝>铝 |
| B | 溶液中加入盐酸酸化的BaCl2溶液有白色沉淀生成 | 该溶液中一定含有SO42- |
| C | 碳酸钠溶液能使酚酞试液变红 | 碳酸钠溶液呈碱性 |
| D | 常温下,铜与冷的浓H2SO4不反应 | 铜与浓硫酸发生钝化 |
化学反应NaOH+HCl==NaCl+H2O属于
| A.化合反应 | B.分解反应 | C.复分解反应 | D.置换反应 |
下列反应所得溶液中一定只含一种溶质的是
| A.向AlCl3溶液中滴入NaOH溶液 | B.向NaOH溶液中通入SO2气体 |
| C.向稀硝酸中加入过量铁粉 | D.向Na2CO3溶液中滴入盐酸 |
下列说法正确的是( )
| A.有些活泼金属如铝可用作热还原法的还原剂 |
| B.用电解NaCl溶液的方法来冶炼金属钠 |
| C.可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝 |
| D.使元素由化合态转化成游离态的过程就是还原的过程 |