题目内容
【题目】回答下列问题:
(1)相同物质的量的CO2和O2 , 其原子数之比为 , 电子数之比为;质量相同的CO2和O2 , 其物质的量之比为 .
(2)19g某二价金属的氯化物ACl2中含有0.4mol Cl﹣ , 则ACl2的摩尔质量 , 画出A2+的结构示意图 .
(3)在一定温度和压强下,5体积气体A2跟15体积的气体B2完全化合生成10体积某气体C,则该气体C的化学式为(用A、B表示) .
(4)用KMnO4氧化浓盐酸溶液.反应方程式如下:KMnO4+HCl﹣﹣MnCl2+KCl+Cl2+H2O
①配平并标出电子转移的方向和数目: .
②若有4.48L氯气(标准状况)生成,则被氧化的HCl的物质的量是 .
【答案】
(1)3:2,11:8,8:11
(2)95 g?mol﹣1,![]()
(3)AB3或B3A
(4)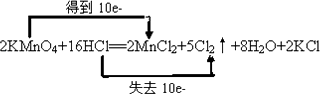 ,0.4mol
,0.4mol
【解析】解:(1)相同物质的量的CO2和O2,其含有的O的物质的量为3:2,则其原子数之比为3:2,则电子数之比为22:16=11:8;质量相同的CO2和O2,其物质的量之比为 ![]() =8:11;
=8:11;
所以答案是:3:2;11:8;
(2)19g某二价金属的氯化物ACl2中含有0.4mol Cl﹣,则ACl2的物质的量为0.2mol,摩尔质量= ![]() =95g/mol;ACl2中A的相对原子质量=95﹣35.5×2=24;依据相对原子质量为24,为镁,则Mg2+的结构示意图为
=95g/mol;ACl2中A的相对原子质量=95﹣35.5×2=24;依据相对原子质量为24,为镁,则Mg2+的结构示意图为 ![]() ;
;
所以答案是:95g/mol; ![]() ;
;
(3)由于5体积气体A2跟15体积的气体B2完全化合生成10体积某气体C,所以A2、B2、C的化学计量数之比为1:3:2,所以方程式为A2+3B2=2C,根据原子守恒可知C的化学式为AB3或B3A,
所以答案是:AB3或B3A;
(4)①在该反应中锰从+7价降为+2价,氯从﹣1价升为0价,在氧化还原反应元素化合价升高的总数与降低的总数应相等,结合质量守恒可知,该反应的方程式为2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O,该反应转移10e﹣,双线桥标出电子的转移方向和数目为  ,
,
所以答案是: 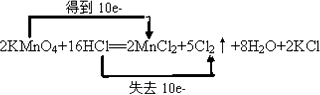 ;
;
②若有4.48L氯气(标准状况)生成,则n(Cl2)= ![]() =0.2mol,反应生成被氧化的HCl全转化为氯气,由Cl守恒可知,被氧化的HCl为0.4mol;
=0.2mol,反应生成被氧化的HCl全转化为氯气,由Cl守恒可知,被氧化的HCl为0.4mol;
所以答案是:0.4mol.

 应用题作业本系列答案
应用题作业本系列答案