题目内容
NA代表阿伏加德罗常数的数值。下列有关叙述正确的是
| A.50℃时,pH=1的1.0L H2SO4溶液中含有的H+数目为0.1 NA |
| B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2 NA |
| C.室温下,21.0g乙烯和丁烯的混合气体中含有的氢原子数目为1.5NA |
| D.3.4gNH3中含N—H键数目为0.2NA |
A
解析试题分析:温度只影响水的离子积,所以pH=1,即C(H+)=0.1mol/L,体积1L,则H+ 数目为0.1 NA ,A正确;标况下2.24L氯气等于0.1mol,所以与氢氧化钠反应化合价一半升高,一半降低,转移电子0.1 NA ,B错误;乙烯和丁烯的最简式为CH2,所以n(CH2)=21.0g÷14g/mol=1.5mol,所以含有氢原子为3 NA ,C错误;3.4g氨气等于0.2mol,每个氨气分子中含有3个N-H键,所以总共含N-H键0.6 NA 。
考点:本题考查的是阿伏伽德罗常数的应用计算。

下列有关化学用语表示正确的是
A.N2的电子式: |
B.S2-的结构示意图: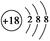 |
C.质子数为53,中子数为78的碘原子: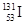 |
| D.乙烯的分子式: CH2=CH2 |
使用容量瓶配置溶液时,由于操作不当会引起误差,下列情况会使所配溶液浓度偏低的是 ( )
①用天平称量时所用砝码生锈
②用量筒量取所需浓溶液时,仰视刻度
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,俯视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
| A.②⑤ | B.②③⑥ | C.①⑤⑥ | D.③⑥ |
相同物质的量的N2和CO两者相比较,下列说法不正确的是
| A.所占的体积一定相等 | B.所含原子总数相等 |
| C.所含电子总数相等 | D.所含分子数相等 |
工业上常用FeCl3溶液与铜反应制作印刷电路板。该反应的化学方程式为:
2FeCl3 + Cu = 2FeCl2 + CuCl2 。取上述反应后溶液10 mL进行分析,测得其中c(Fe3+)为1mol·L—1。向其中加入足量的硝酸银溶液,过滤、干燥,可得到沉淀l7.22g。则上述反应后的10mL溶液中c(Cu2+)为
| A.0.5mol·L—1 | B.1.5 mol·L—1 | C.0.4 mol·L—1 | D.0.25 mol·L—1 |
食盐、蔗糖、醋酸、纯碱、汽油、“84消毒液”等是日常生活中经常使用的物质,下列有关说法或表示正确的是
A.食盐中阴离子的核外电子排布结构示意图为: |
| B.纯碱与汽油去除油污的原理相同 |
C.“84消毒液”中有效成分NaClO的电子式为: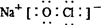 |
| D.蔗糖与醋酸的最简式相同 |
设NA为阿伏加德罗常数的值,下列叙述正确的是 ( )
| A.标准状况下, 22.4 L H2O含有分子数为NA |
| B.分子总数为NA的N2、CO混合气体体积约为22.4 L,质量为28 g |
| C.常温常压下,1.6 g CH4含原子数为0.5NA |
| D.足量的CO2与39 g Na2O2发生反应,转移的电子数为NA |
铅笔芯的主要成分是石墨。如果铅笔芯写一个字消耗的石墨质量约为1×10-3g,。那么一个铅笔字含有的碳原子数约为
| A.5×1019个 | B.5×1022个 | C.2.5×1022个 | D.2.5×1019个 |
下列表示物质结构的化学用语正确的是
| A.含7个中子的碳原子符号:12C |
B.NaCl的电子式:?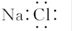 |
C.氯原子的结构示意图: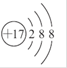 |
D.CSO的电子式: ? ? |