题目内容
(14分)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值。
(1)实验室利用反应可制备氧气。
①取等物质的量浓度等体积溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
| 序号 | 条件 | 现象 | 结论 | |
| 1 | 温度/℃ | 催化剂 | ||
| 2 | 40 | FeCl3溶液 |
|
|
| 3 | 20 | FeCl3溶液 |
|
|
| 4 | 20 | MnO2 |
|
|
| 5 | 20 | 无 |
|
|
实验1、2研究的是 对H2O2分解速率的影响。
实验2、3的目的是 。
实验中可以表明该反应速率差异的现象是 。
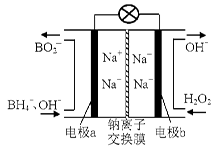
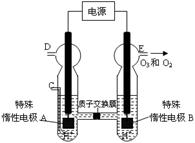
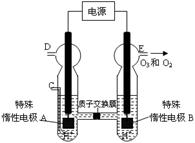
②实验室用MnO2做该反应的催化剂,使用如右图所示装置的A部分制备O2,避免反应过于剧烈的操作是 。
(2)Na2O2与水反应也可生成O2。某同学取4 g Na2O2样品与过量水反应,待反应完全终止时,得100 mL溶液X和448 mL O2(已折算为标准状况)。该同学推测样品中含有杂质或反应中生成H2O2,并进行实验研究。
①取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀。则反应的离子方程式是 。
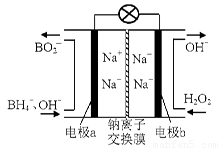
②通过如上图所示整套实验装置测定Na2O2样品的纯度,假设所含杂质不参加反应。取25 mL X,滴入烧瓶内使其与过量KMnO4酸性溶液反应,最终生成56 mL O2(已折算为标准状况),则此样品中:Na2O2的质量分数是 。
(1)①温度;比较FeCl3溶液和MnO2作为催化剂对H2O2分解反应速率影响的差异;产生气泡的快慢
②旋转分液漏斗的活塞,控制滴加H2O2溶液的速率
(2)①2Fe2++4OH-+H2O2=2Fe(OH)3↓
②97.5%
解析:

(14分)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值。
(1)实验室利用反应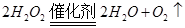 可制备氧气。
可制备氧气。
①取等物质的量浓度等体积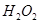 溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
|
序号 |
条件 |
现象 |
结论 |
|
|
1 |
温度/℃ |
催化剂 |
||
|
2 |
40 |
FeCl3溶液 |
|
|
|
3 |
20 |
FeCl3溶液 |
|
|
|
4 |
20 |
MnO2 |
|
|
|
5 |
20 |
无 |
|
|
实验1、2研究的是 对H2O2分解速率的影响。
实验2、3的目的是 。
实验中可以表明该反应速率差异的现象是 。
②实验室用MnO2做该反应的催化剂,使用如右图所示装置的A部分制备O2,避免反应过于剧烈的操作是 。

(2)Na2O2与水反应也可生成O2。某同学取4 g Na2O2样品与过量水反应,待反应完全终止时,得100 mL溶液X和448 mL O2(已折算为标准状况)。该同学推测样品中含有杂质或反应中生成H2O2,并进行实验研究。
①取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀。则反应的离子方程式是 。
②通过如上图所示整套实验装置测定Na2O2样品的纯度,假设所含杂质不参加反应。取25 mL X,滴入烧瓶内使其与过量KMnO4酸性溶液反应,最终生成56 mL O2(已折算为标准状况),则此样品中:Na2O2的质量分数是 。
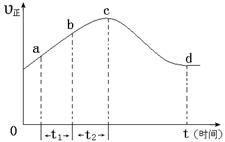
 以上是以NO形式存在的,可发生反应NO(g)+ O3 (g)
以上是以NO形式存在的,可发生反应NO(g)+ O3 (g)  NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是
NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是 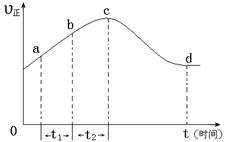
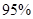 以上是以NO形式存在的,可发生反应NO(g)+ O3 (g)
以上是以NO形式存在的,可发生反应NO(g)+ O3 (g)  NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是
NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是