题目内容
过度排放CO2会造成“温室效应”,为了减少煤燃烧对环境造成的污染,煤的气化是高效、清洁利用煤炭的重要途径。煤综合利用的一种途径如图所示。

(1)已知①C(s) + H2O(g) = CO(g)+H2(g) ΔH1=+131.3 kJ·mol-1
②C(s) + 2H2O(g) = CO2(g) + 2H2(g) ΔH2=+90 kJ·mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 ________________________,
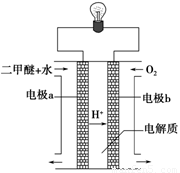
(2)用下图原电池装置可以完成过程⑤的转化,该装置b电极的电极反应式是_______________________。
(3)在压强为0.1 MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇:
CO(g)+2H2(g) 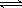 CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:

①p1________p2(填“>”、“<”或“=”)。
②在其他条件不变的情况下,向容器中再增加a mol CO与2a mol H2,达到新平衡时,CO的平衡转化率________(填“增大”、“减小”或“不变”)。
③在p1下,100 ℃时,CO(g)+2H2(g)
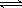 CH3OH(g)反应的平衡常数为________(用含a、V的代数式表示)。
CH3OH(g)反应的平衡常数为________(用含a、V的代数式表示)。
(4)如图表示CO2与H2反应生成CH3OH和H2O的过程中能量(单位为kJ·mol-1)的变化:

关于该反应的下列说法中,正确的是________(填编号)。
A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0
C.ΔH<0,ΔS<0 D.ΔH<0,ΔS>0
(5)为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol
CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)
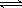 CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:

①从反应开始到平衡,CO2的平均反应速率v(CO2)=________。
②下列措施中能使化学平衡向正反应方向移动的是________(填编号)。
A.升高温度 B.将CH3OH(g)及时液化移出
C.选择高效催化剂 D.再充入1 mol CO2和3 mol H2
(1) CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.3 kJ·mol-1 (2) O2 +4e- +2H2O = 4OH— (3)①<② V 2 / a2 ③增大 (4)C (5)①0.075 mol/( L·min). ②BD
【解析】
试题分析:(1)②-①可得:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.3 kJ/mol.. (2)在燃料电池中,通入燃料的电极作负极,通入氧气的电极作正极。a电极是负极,b电极是正极。b电极的电极反应式是O2 +4e-
+2H2O = 4OH— (3)
①由图可以看出:在温度相同时,转化率P2>P1。根据平衡移动原理:在其它条件不变的情况下。增大压强,化学平衡向气体体积减小的方向移动。即向正反应方向移动。这时反应物的转化率提高。所以P1<P2. ②在其他条件不变的情况下,向容器中再增加a mol CO与2a mol H2。即增大了体系的压强,这时化学平衡向正反应方向移动。故达到新平衡时,CO的平衡转化率增大。③在p1下,100 ℃时,CO(g)+2H2(g)
 CH3OH(g)反应的平衡常数为K=C (CH3OH)/ { C(CO)·C2(H2)}
=( a/2V):{(a/2V) ·(a/V)}2= V 2
/ a2.(4)CO2(g)+3H2(g)
CH3OH(g)反应的平衡常数为K=C (CH3OH)/ { C(CO)·C2(H2)}
=( a/2V):{(a/2V) ·(a/V)}2= V 2
/ a2.(4)CO2(g)+3H2(g) CH3OH(g)+CO(g).由图可看出该反应的正反应是放热反应。该反应的正反应是个气体体积减小的放热反应。所以△H<0;△S<0。选项为:C。(5)①从反应开始到平衡,CO2的平均反应速率v(CO2)=(1-0.25)mol/L÷10min=0.075 mol/(
L·min). ②A升高温度化学平衡向吸热方向移动。由于该反应的正反应是放热反应所以升高温度化学平衡向逆反应方向移动。B.减小生成物的浓度,化学平衡向正反应方向移动。故将CH3OH(g)及时液化移出可使平衡向正反应方向移动,C.催化剂 对化学平衡无影响。D.达到平衡时若再充入1 mol CO2和3 mol
H2 ,即增大了压强,化学平衡向气体体积减小的方向及正反应方向移动。所以能使化学平衡向正反应方向移动的措施是BD。
CH3OH(g)+CO(g).由图可看出该反应的正反应是放热反应。该反应的正反应是个气体体积减小的放热反应。所以△H<0;△S<0。选项为:C。(5)①从反应开始到平衡,CO2的平均反应速率v(CO2)=(1-0.25)mol/L÷10min=0.075 mol/(
L·min). ②A升高温度化学平衡向吸热方向移动。由于该反应的正反应是放热反应所以升高温度化学平衡向逆反应方向移动。B.减小生成物的浓度,化学平衡向正反应方向移动。故将CH3OH(g)及时液化移出可使平衡向正反应方向移动,C.催化剂 对化学平衡无影响。D.达到平衡时若再充入1 mol CO2和3 mol
H2 ,即增大了压强,化学平衡向气体体积减小的方向及正反应方向移动。所以能使化学平衡向正反应方向移动的措施是BD。
考点:考查热化学方程式的书写、化学平衡常数的计算及外界条件对化学平衡的影响等知识。



 CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:




 CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则: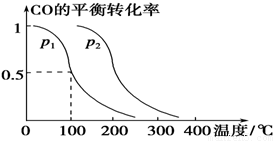


 CH3OH(g)+H2O(g)
ΔH>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)
ΔH>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示。

 CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。