题目内容
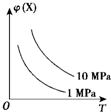 如图所示,φ(X)为气态反应物在平衡混合物中的体积分数,T为温度.符合该曲线的反应是( )
如图所示,φ(X)为气态反应物在平衡混合物中的体积分数,T为温度.符合该曲线的反应是( )| A、N2(g)+3H2(g)?2NH3(g)△H<0 | B、H2(g)+I2(g)?2HI(g)△H<0 | C、4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | D、C(s)+H2O(g)?H2(g)+CO(g)△H>0 |
分析:根据图示信息知道:当压强不变,升高温度时,气态反应物在平衡混合物中的体积分数减小,即化学平衡正向移动,反应是吸热反应;当温度不变时,增大压强,气态反应物在平衡混合物中的体积分数增大,则化学平衡逆向进行,说明逆向是气体系数和减小的方向,据此回答判断.
解答:解:当压强不变,升高温度时,气态反应物在平衡混合物中的体积分数减小,即化学平衡正向移动,反应是吸热反应;当温度不变时,增大压强,气态反应物在平衡混合物中的体积分数增大,则化学平衡逆向进行,说明逆向是气体系数和减小的方向.
A、该反应是放热反应,且逆向是气体系数和增大的方向,不符合题意,故A错误;
B、该反应是放热反应,且前后气体系数和相等的,压强不会引起该平衡的移动,不符合题意,故B错误;
C、该反应是放热反应,不符合题意,故C错误;
D、该反应是放热反应,且逆向是气体系数和减小的方向,符合题意,故D正确;
故选D.
A、该反应是放热反应,且逆向是气体系数和增大的方向,不符合题意,故A错误;
B、该反应是放热反应,且前后气体系数和相等的,压强不会引起该平衡的移动,不符合题意,故B错误;
C、该反应是放热反应,不符合题意,故C错误;
D、该反应是放热反应,且逆向是气体系数和减小的方向,符合题意,故D正确;
故选D.
点评:本题考查学生影响化学平衡移动的因素:温度、压强等,注意图象题的分析方法,固定变量法是常用的处理方式,难度不大.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目

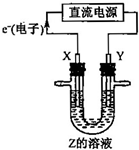 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( ) (2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.
(2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.
 如图所示装置中,X和Y均为石墨电极.
如图所示装置中,X和Y均为石墨电极.