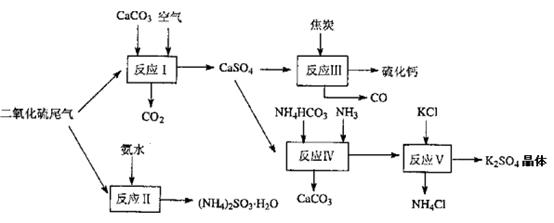
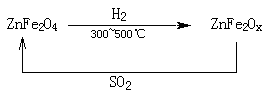
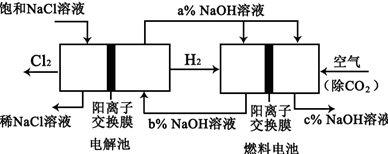
题目内容
在H2SO4、HNO3、NH3的工业生产中,具有的共同点是
| A.使用H2作原料 | B.使用催化剂 |
| C.使用吸收塔设备 | D.使用尾气吸收装置 |
B
试题分析:A、H2SO4不用H2作原料,错误;B、SO2到SO3需要催化剂,NH3的合成与氧化需要催化剂,正确;C、NH3的合成不使用吸收塔设备,错误;D、工业生产中原料充分利用,一般有毒气体较少排放,错误。

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目