��Ŀ����
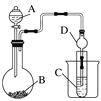
����Ŀ����1��ij����С��ͬѧ��ͼ1װ�ý���ʵ�飬�Իش��������⣺
������ʼʱ����K��a���ӣ����������绯ѧ��ʴ�е� ��ʴ��
������ʼʱ����K��b���ӣ����ܷ�Ӧ�����ӷ���ʽΪ ��
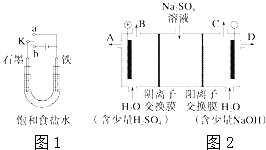
��2��â����ѧʽΪNa2SO410H2O����ɫ���壬������ˮ����һ�ֲַ��ܹ㷺�������ο����С��ͬѧ���룬���ģ�ҵ�����ӽ���Ĥ�����ռ�ķ���������ͼ2��ʾװ�õ����������Һ����ȡ������������������������ƣ����۴ӽ�ʡ��Դ���Ǵ����ԭ�ϵ������ʶ��Զ����ӷ�����ɫ��ѧ���
�ٸõ��۵�������ӦʽΪ ����ʱͨ�������ӽ���Ĥ�������� ������ڡ�����С�ڡ����ڡ���ͨ�������ӽ���Ĥ����������
���Ƶõ�����������Һ�ӳ��ڣ��A������B������C����D���� ������
��ͨ�翪ʼ������������ҺpH�����������ԭ��
�������Ƶõ�����������������������Һ���Ϊ����ȼ�ϵ�أ����ظ����ĵ缫��ӦʽΪ ����֪H2��ȼ����Ϊ285.8kJmol��1�����ȼ�ϵ�ع�������36g H2Oʱ���������� kJ������ת��Ϊ���ܣ�
���𰸡���1����������
��2Cl��+2H2O![]() 2OH��+H2��+Cl2����
2OH��+H2��+Cl2����
��2����4OH����4e��=2H2O+O2����С�ڣ�
��D��
��H+�ŵ磬�ٽ�ˮ�ĵ��룬OH��Ũ������
��H2+2OH����2e��=2H2O��571.6
��������
�����������1��������ʼʱ����K��a���ӣ���װ����ԭ��أ������������Ի����������·���������ʴ����ǿ���������·������ⸯʴ��
������ʼʱ����K��b���ӣ���װ���ǵ��أ�ʯī��������Fe�������������������ӷŵ硢������ˮ�õ�����������ͬʱ�������������ӣ�
��2���ٸõ��۵�������ˮʧ�������������������ӣ������ӽ���Ĥ�����������������ӡ�ͨ�������ӽ���Ĥ�������������ӣ����ݵ���غ��жϣ�
��������ˮ�õ�������������OH���������ɵ�NaOHӦ��������������
��ͨ�翪ʼ��������ˮ�õ����������������������ӣ�������Һ������ǿ��
������ȼ�ϼ��Ե���У���ظ���������ʧ���Ӻ����������ӷ�Ӧ����ˮ��
H2��ȼ����Ϊ285.8kJmol��1��n��H2O��=![]() =2mol��������ԭ���غ�֪������2molˮ��Ҫ2mol�������ݴ˼��㷴Ӧ�ȣ�
=2mol��������ԭ���غ�֪������2molˮ��Ҫ2mol�������ݴ˼��㷴Ӧ�ȣ�
�⣺��1���ٿ���K��a���ӣ�Ϊԭ��أ�NaCl��ҺΪ���ԣ�����������ʴ���ʴ�Ϊ��������
��K��b���ӣ�Ϊ���أ�����ʼʱ����K��b����ʱ��Fe��������ʯī�������������ӡ������ӷŵ磬���������ӷ�ӦΪ2Cl��+2H2O![]() 2OH��+H2��+Cl2����
2OH��+H2��+Cl2����
�ʴ�Ϊ��2Cl��+2H2O![]() 2OH��+H2��+Cl2����
2OH��+H2��+Cl2����
��2���ٵ��ʱ��������ʧ���ӷ���������Ӧ����Һ�е����������ӵķŵ�����������������ӵķŵ���������������������������ʧ��������ˮ������4OH����4e��=2H2O+O2�����������������ӷŵ磬�������������������ƶ������������ӷŵ磬����������������ƶ�������ͨ����ͬ����ʱ��ͨ�������ӽ���Ĥ��������С��ͨ�������ӽ���Ĥ�����������ʴ�Ϊ��4OH����4e��=2H2O+O2����С�ڣ�
�������������������ɣ�������D�ڵ������ʴ�Ϊ��D��
��ͨ�翪ʼ�������������ӷŵ�����������������������ˮ�����Դٽ�ˮ�ĵ��룬������Һ�����������ӵ�Ũ�ȴ��������ӵ�Ũ�ȣ�������Һ��pHֵ����
�ʴ�Ϊ��H+�ŵ磬�ٽ�ˮ�ĵ��룬OH��Ũ������
������������������������Һ���Ϊ����ȼ�ϵ�أ�����������ʧȥ���Ӻ����������ӷ�Ӧ����ˮ���缫��ӦʽΪH2+2OH����2e��=2H2O��H2��ȼ����Ϊ285.8kJ/mol����2H2��g��+O2��g��=2H2O��l����H=��571.6kJ/mol����ȼ�ϵ�ع�������36g H2O��n��H2O��=![]() =2mol����ȼ�յ��ȷ���ʽ��֪������2molH2O�ų�571.6kJ������������������571.6kJ������ת��Ϊ���ܣ�
=2mol����ȼ�յ��ȷ���ʽ��֪������2molH2O�ų�571.6kJ������������������571.6kJ������ת��Ϊ���ܣ�
�ʴ�Ϊ��H2+2OH����2e��=2H2O��571.6