题目内容
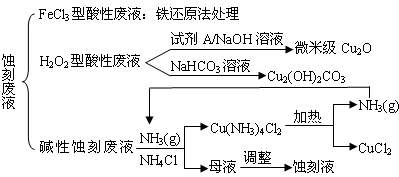
近来我国的电子工业迅速发展,造成了大量的电路板蚀刻废液的产生和排放.蚀刻液主要有酸性的(HCl-H2O2)、传统的FeCl3型(HCl-FeCl3)等方法.蚀刻废液中含有大量的Cu2+,废液的回收利用可减少铜资源的流失.其中几种蚀刻废液的常用处理方法如下:

(1)FeCl3型酸性废液用还原法处理是利用Fe和Cl2分别作为还原剂和氧化剂可回收铜并使蚀刻液再生.发生的主要化学反应有:
Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑,还有 、 .(用离子方程式表示)
(2)HCl-H2O2型蚀刻液在蚀刻电路板过程中发生的化学反应用化学方程式可表示为:
.
(3)H2O2型酸性废液处理回收微米级Cu2O过程中加入的试剂A的最佳选择是下列中的 (填序号).
①酸性KMnO4溶液 ②NaCl(固) ③甲醛 ④葡萄糖
(4)处理H2O2型酸性废液回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时产品颜色发暗,其原因可能是 .

(1)FeCl3型酸性废液用还原法处理是利用Fe和Cl2分别作为还原剂和氧化剂可回收铜并使蚀刻液再生.发生的主要化学反应有:
Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑,还有
(2)HCl-H2O2型蚀刻液在蚀刻电路板过程中发生的化学反应用化学方程式可表示为:
(3)H2O2型酸性废液处理回收微米级Cu2O过程中加入的试剂A的最佳选择是下列中的
①酸性KMnO4溶液 ②NaCl(固) ③甲醛 ④葡萄糖
(4)处理H2O2型酸性废液回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时产品颜色发暗,其原因可能是
分析:(1)FeCl3型酸性废液中含有Fe3+和Fe2+,Fe3+具有氧化性,可与Fe反应,Fe2+具有还原性,可与Cl2反应;
(2)H2O2在酸性条件下具有强氧化性,可氧化Cu生成CuCl2;
(3)HCl-H2O2型蚀刻液含有Cu2+,在碱性条件下生成Cu(OH)2,可与弱还原剂生成Cu2O;
(4)Cu2(OH)2CO3易分解生成黑色CuO.
(2)H2O2在酸性条件下具有强氧化性,可氧化Cu生成CuCl2;
(3)HCl-H2O2型蚀刻液含有Cu2+,在碱性条件下生成Cu(OH)2,可与弱还原剂生成Cu2O;
(4)Cu2(OH)2CO3易分解生成黑色CuO.
解答:解:(1)FeCl3型酸性废液中含有Fe3+和Fe2+,Fe3+具有氧化性,可与Fe反应,离子方程式为Fe+2Fe3+=3Fe2+,Fe2+具有还原性,可与Cl2反应,离子方程式为2Fe2++Cl2=2Fe3++2Cl-,
故答案为:Fe+2Fe3+=3Fe2+;2Fe2++Cl2=2Fe3++2Cl-;
(2)H2O2在酸性条件下具有强氧化性,可氧化Cu生成CuCl2,反应的化学方程式为Cu+2HCl+H2O2=CuCl2+2H2O,
故答案为:Cu+2HCl+H2O2=CuCl2+2H2O;
(3)HCl-H2O2型蚀刻液含有Cu2+,在碱性条件下生成Cu(OH)2,Cu(OH)2可与弱还原剂(例如含有醛基的有机物)生成Cu2O,选项中葡萄糖和甲醛都可,但葡萄糖资源广,无害,最合适,故答案为:③;
(4)当温度高于80℃时,Cu2(OH)2CO3易分解生成黑色CuO,导致产品颜色发暗,
故答案为:温度高会使产物部分分解产生黑色的氧化铜,导致产品颜色发暗.
故答案为:Fe+2Fe3+=3Fe2+;2Fe2++Cl2=2Fe3++2Cl-;
(2)H2O2在酸性条件下具有强氧化性,可氧化Cu生成CuCl2,反应的化学方程式为Cu+2HCl+H2O2=CuCl2+2H2O,
故答案为:Cu+2HCl+H2O2=CuCl2+2H2O;
(3)HCl-H2O2型蚀刻液含有Cu2+,在碱性条件下生成Cu(OH)2,Cu(OH)2可与弱还原剂(例如含有醛基的有机物)生成Cu2O,选项中葡萄糖和甲醛都可,但葡萄糖资源广,无害,最合适,故答案为:③;
(4)当温度高于80℃时,Cu2(OH)2CO3易分解生成黑色CuO,导致产品颜色发暗,
故答案为:温度高会使产物部分分解产生黑色的氧化铜,导致产品颜色发暗.
点评:本题考查含铜工业废液的处理,题目难度中等,本题考查较为综合,答题时注意把握题给信息,结合元素化合物知识解答.

练习册系列答案
相关题目