题目内容
【题目】氮化硼(BN)被称为一种“宇宙时代的材料”,具有很大的硬度。
(1)基态硼原子有__________个未成对电子,氮离子的电子排布式为__________。
(2)部分硼的化合物有以下转化:![]()
则下列叙述正确的是__________(填序号);
A.B3N3H6俗称无机苯,但不是平面分子
B.BNH6与乙烷是等电子体
C.HB≡NH中的硼原子、氮原子的杂化类型相同
D.硼、氮、氧三元素的第一电离能比较:B<N<O
(3)下图的晶体结构中,黑球白球分别代表不同的原子、离子或分子,则图1的晶胞中含有的粒子总数为__________;图2中的白球的配位数是__________。
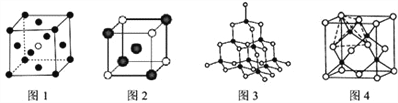
(4)已知图3、4均表示BN晶体的结构,制备氮化硼的原理为:BCl3+2NH3=BN+2HCl+NH4Cl,当该反应中有1mol BN生成时,则反应中可形成__________mol配位键,比较氮化硼晶体与晶体硅的沸点高低并解释原因________________________
【答案】 1 1s22s22p6 B、C 5 8 2 氮化硼晶体比晶体硅高,氮硼键的键长比硅硅键的键长短,键能比硅硅键的键能大
【解析】试题分析:(1) B原子核外电子排布是1S22S2P1,2P能级有1个未成对电子;N3-核外有10个电子,电子排布式为1S22S2P6;(2) B3N3H6与苯为等电子体,结构相似,为平面结构,故A错误; BNH6与乙烷是原子总数相同、电子数相同的等电子体,故B正确;;HB≡NH中的硼原子、氮原子均有2个δ键、没有孤对电子,杂化轨道数均为2,为SP杂化,杂化类型相同,故C正确;同周期元素从左到右第一电离能增大,但氮原子2p轨道有3个电子,能量较低,第一电离能比较:B<O <N,故D错误; (3)图1的晶胞含有的原子数![]() ;图2与白色球最近的黑色球处于体心位置,每个顶点的白球被8个晶胞共用,白球的配位数是8;(4)原子B、N原子之间有4个共价键,生成1 molBN时,形成1mol配位键,同时得到1mol氯化铵,1个铵根离子中也有1个配位键,所以形成配位键数为2 mol,原子半径越小形成的共价键越稳定,沸点越高。
;图2与白色球最近的黑色球处于体心位置,每个顶点的白球被8个晶胞共用,白球的配位数是8;(4)原子B、N原子之间有4个共价键,生成1 molBN时,形成1mol配位键,同时得到1mol氯化铵,1个铵根离子中也有1个配位键,所以形成配位键数为2 mol,原子半径越小形成的共价键越稳定,沸点越高。
解析:(1) B原子核外电子排布是1S22S2P1;N3-核外有10个电子;(2) B3N3H6与苯为等电子体,结构相似;BNH6与乙烷是原子总数相同、电子数相同的等电子体;HB≡NH中的硼原子、氮原子均有2个δ键、没有孤对电子,杂化轨道数均为2,,杂化类型相同;同周期元素从左到右第一电离能增大,但氮原子2p轨道有3个电子,能量较低; (3)图1的晶胞含有的原子数根据均摊原则计算;图2与白色球最近的黑色球处于体心位置,每个顶点的白球被8个晶胞共用;(4)原子B、N原子之间有4个共价键,生成1 molBN时,形成1mol配位键,同时得到1mol氯化铵,1个铵根离子中也有1个配位键,所以形成配位键数为2 mol,原子半径越小形成的共价键越稳定,沸点越高,氮硼键的键长比硅硅键的键长短,键能比硅硅键的键能大,所以氮化硼晶体比晶体硅高。

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案