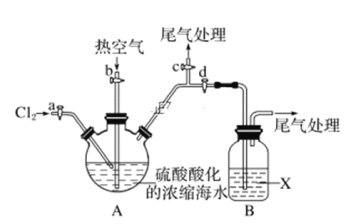
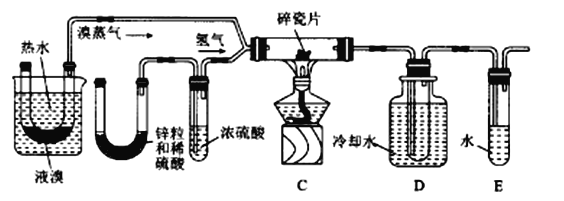
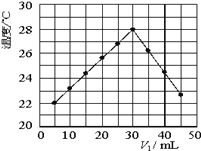
题目内容
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对比中学常见元素周期表,思考扇形元素周期表的填充规律,下列说法正确的是
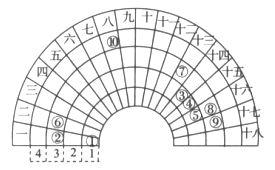
A. ②、⑧、⑨对应简单离子半径依次减小
B. 该表中标注的元素全部是主族元素
C. 元素⑥和⑦的原子序数相差11
D. ④的最高价氧化物对应的水化物能与其氢化物反应,生成离子化合物
【答案】D
【解析】
由元素在周期表中的位置可以知道,①为H、②为Na、③为C、④为N、⑤为O、⑥为Mg、⑦为Al、⑧为S、⑨为Cl、⑩为Fe,则
A.②为Na、⑧为S、⑨为Cl,电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->Cl->Na+,A错误;
B.⑩为Fe,为副族元素,B错误;
C.元素⑥为Mg,元素⑦为Al,两原子序数相差1,C错误;
D.④的最高价氧化物对应的水化物为HNO3,其氢化物为NH3两者可以发生反应,D正确。
答案选D。

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目