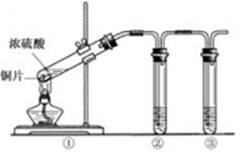
题目内容
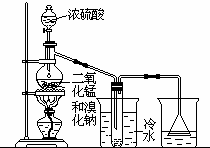 根据右上图实验,填空和回答问题:
根据右上图实验,填空和回答问题:
(1)烧瓶中所发生的主要反应的化学方程式是______,装置(Ⅱ)的烧杯中冷水所起的作用是______,装置(Ⅲ)的烧杯中液体的作用是______.
(2)进行此实验时,烧瓶内的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,这是因为______.
(3)装置(Ⅲ)烧杯中使用倒置漏斗可防止液体倒吸,试简述其原因.
______.
解:(1)由浓硫酸与氯化钠反应生成氯化氢,以及在加热条件下浓盐酸与二氧化锰反应生成氯气的反应,反应分别为:NaBr+H2SO4 NaHSO4+HBr↑,
NaHSO4+HBr↑,
4HBr(浓)+MnO2═MnBr2+Br2↑+2H2O,可写成2NaBr+3H2SO4+MnO2 2NaHSO4+MnSO4+2H2O+Br2↑或2NaBr+2H2SO4+MnO2
2NaHSO4+MnSO4+2H2O+Br2↑或2NaBr+2H2SO4+MnO2 Na2SO4+MnSO4+2H2O+Br2↑,
Na2SO4+MnSO4+2H2O+Br2↑,
(Ⅱ)溴易挥发,在常温下为液体,要冷凝溴蒸气,溴蒸汽具有强烈的刺激性,不能排放到空气中,应进行尾气吸收,
故答案为;2NaBr+3H2SO4+MnO2 2NaHSO4+MnSO4+2H2O+Br2↑或2NaBr+2H2SO4+MnO2
2NaHSO4+MnSO4+2H2O+Br2↑或2NaBr+2H2SO4+MnO2 Na2SO4+MnSO4+2H2O+Br2↑;冷凝;吸收未冷凝的气体;
Na2SO4+MnSO4+2H2O+Br2↑;冷凝;吸收未冷凝的气体;
(2)溴能腐蚀橡皮管和橡皮塞,与橡胶中的碳碳双键发生加成反应而使橡皮老,化故答案为:溴蒸气会腐蚀橡皮塞和橡皮管;
(3)该实验防止倒吸的原理是水进入到漏斗中与液面脱离,由于自身重力的作用而又回落到烧杯中,从而防止倒吸,
故答案为:当气体被吸收时,液体上升到漏斗中.由于漏斗的容积较大,导致烧杯中液面下降,使漏斗口脱离液面,漏斗中的液体又流回烧杯中,从而防止了倒吸.
分析:(1)本反应类似于浓硫酸与氯化钠反应生成氯化氢,以及在加热条件下浓盐酸与二氧化锰反应生成氯气的反应,可以此来书写化学方程式;溴易挥发,在常温下为液体,要冷凝溴蒸气,并加尾气吸收装置;
(2)溴能腐蚀橡皮管和橡皮塞,使橡皮老化;
(3)溴蒸气易溶于水,收集时应防止倒吸,该装置的特点是气体被吸收时,液体上升到漏斗中.由于漏斗的容积较大,导致烧杯中液面下降,使漏斗口脱离液面,漏斗中的液体又流回烧杯中.
点评:本题考查气体的制备及收集,答题时注意以下要点:①漏斗容积较大,②烧杯中液面下降,使漏斗口脱离液面(或使液面低于漏斗口).
 NaHSO4+HBr↑,
NaHSO4+HBr↑,4HBr(浓)+MnO2═MnBr2+Br2↑+2H2O,可写成2NaBr+3H2SO4+MnO2
 2NaHSO4+MnSO4+2H2O+Br2↑或2NaBr+2H2SO4+MnO2
2NaHSO4+MnSO4+2H2O+Br2↑或2NaBr+2H2SO4+MnO2 Na2SO4+MnSO4+2H2O+Br2↑,
Na2SO4+MnSO4+2H2O+Br2↑,(Ⅱ)溴易挥发,在常温下为液体,要冷凝溴蒸气,溴蒸汽具有强烈的刺激性,不能排放到空气中,应进行尾气吸收,
故答案为;2NaBr+3H2SO4+MnO2
 2NaHSO4+MnSO4+2H2O+Br2↑或2NaBr+2H2SO4+MnO2
2NaHSO4+MnSO4+2H2O+Br2↑或2NaBr+2H2SO4+MnO2 Na2SO4+MnSO4+2H2O+Br2↑;冷凝;吸收未冷凝的气体;
Na2SO4+MnSO4+2H2O+Br2↑;冷凝;吸收未冷凝的气体;(2)溴能腐蚀橡皮管和橡皮塞,与橡胶中的碳碳双键发生加成反应而使橡皮老,化故答案为:溴蒸气会腐蚀橡皮塞和橡皮管;
(3)该实验防止倒吸的原理是水进入到漏斗中与液面脱离,由于自身重力的作用而又回落到烧杯中,从而防止倒吸,
故答案为:当气体被吸收时,液体上升到漏斗中.由于漏斗的容积较大,导致烧杯中液面下降,使漏斗口脱离液面,漏斗中的液体又流回烧杯中,从而防止了倒吸.
分析:(1)本反应类似于浓硫酸与氯化钠反应生成氯化氢,以及在加热条件下浓盐酸与二氧化锰反应生成氯气的反应,可以此来书写化学方程式;溴易挥发,在常温下为液体,要冷凝溴蒸气,并加尾气吸收装置;
(2)溴能腐蚀橡皮管和橡皮塞,使橡皮老化;
(3)溴蒸气易溶于水,收集时应防止倒吸,该装置的特点是气体被吸收时,液体上升到漏斗中.由于漏斗的容积较大,导致烧杯中液面下降,使漏斗口脱离液面,漏斗中的液体又流回烧杯中.
点评:本题考查气体的制备及收集,答题时注意以下要点:①漏斗容积较大,②烧杯中液面下降,使漏斗口脱离液面(或使液面低于漏斗口).

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
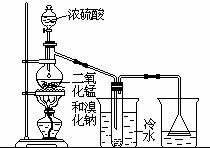 根据右上图实验,填空和回答问题:
根据右上图实验,填空和回答问题: