题目内容
甲酸和乙酸都是弱酸,当它们的浓度均为0.10mol·L-1时,甲酸中c(H+)约为乙酸中c(H+)的3倍。现有两种浓度不等的甲酸溶液a和b,以及0.10mol·L-1的乙酸,经测定它们的pH从大到小依次为a、乙酸、b。由此可知
- A.a的浓度必小于乙酸的浓度
- B.a的浓度必大于乙酸的浓度
- C.b的浓度必小于乙酸的浓度
- D.b的浓度必大于乙酸的浓度
A
解析:
由于c(HCOOH)=c(CH3COOH)=0.1mol·L-1时,甲酸中的c(H+)约为乙酸中c(H+)的3倍,故甲酸的酸性强于乙酸的酸性。又因pH(a)>pH(CH3COOH)>pH(b),即溶液a的c(H+)<0.1mol·L-1,CH3COOH的c(H+)<溶液b的c(H+),所以a的浓度小于乙酸的浓度,但无法确定乙酸与b的浓度的相对大小(因HCOOH酸性>CH3COOH酸性),所以答案选A。考点:考查弱电解质的电离平衡知识和酸的相对强弱等问题
点评:该题是中等难度的试题,试题综合性强,难度较大,对学生的思维能力提出了更高的要求,学生不易得分。该题注重能力的培养和解题方法的指导和训练,有助于培养学生严谨的逻辑推理能力和抽象思维能力,提高学生分析问题、解决问题的能力。
解析:
由于c(HCOOH)=c(CH3COOH)=0.1mol·L-1时,甲酸中的c(H+)约为乙酸中c(H+)的3倍,故甲酸的酸性强于乙酸的酸性。又因pH(a)>pH(CH3COOH)>pH(b),即溶液a的c(H+)<0.1mol·L-1,CH3COOH的c(H+)<溶液b的c(H+),所以a的浓度小于乙酸的浓度,但无法确定乙酸与b的浓度的相对大小(因HCOOH酸性>CH3COOH酸性),所以答案选A。考点:考查弱电解质的电离平衡知识和酸的相对强弱等问题
点评:该题是中等难度的试题,试题综合性强,难度较大,对学生的思维能力提出了更高的要求,学生不易得分。该题注重能力的培养和解题方法的指导和训练,有助于培养学生严谨的逻辑推理能力和抽象思维能力,提高学生分析问题、解决问题的能力。

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
 约为乙酸中
约为乙酸中 和
和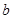 ,以及0.10mol/L的乙酸,经测定它们的pH从大到小依次为
,以及0.10mol/L的乙酸,经测定它们的pH从大到小依次为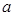 、乙酸、
、乙酸、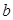 的浓度必小于乙酸的浓度 D、
的浓度必小于乙酸的浓度 D、