题目内容
1836年,俄国科学家盖斯提出了化学反应的热效应仅与反应物的最初状态和生成物的最终状态有关,而与其中间步骤无关。按此规律,结合下述反应的热化学方程式,回答问题:已知火箭发射时可用肼(N2H4)和NO2作燃料,这两者反应生成氮气和水蒸气。
N2(g)+2O2(g)=2NO2(g) ΔH=+67.8kJ?mol-1①
N2H4(g)+O2(g)=N2(g)+2H2O(g)
ΔH=-534kJ?mol-1②
计算1mol气体肼和NO2完全反应时放出热量为________________kJ,写出肼与NO2反应的热化学方程式____________________________________。
567.85kJ?mol-1;N2H4(g)+NO2(g)=
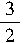 N2(g)+2H2O(g) ΔH=-567.85kJ?mol
N2(g)+2H2O(g) ΔH=-567.85kJ?mol【试题分析】

练习册系列答案
相关题目
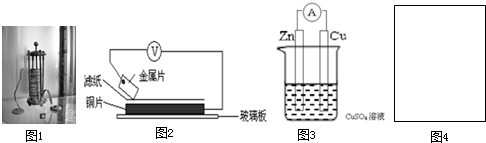
 ”代表反应容器,“
”代表反应容器,“ ”代表导线,“
”代表导线,“ ”代表电极,“
”代表电极,“ ”代表小灯泡,在右侧方框(图4)内画出装置图并指出电极材料和电解质溶液,标出电源的正负极.
”代表小灯泡,在右侧方框(图4)内画出装置图并指出电极材料和电解质溶液,标出电源的正负极.