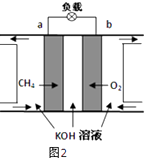
题目内容
【题目】40℃时,在氨﹣水体系中不断通入CO2 , 各种离子的变化趋势如图所示.下列说法不正确的是( ) 
A.在pH=9.0时,c(NH4+)>c(HCO3﹣)>c(NH2COO﹣)>c(CO32﹣)
B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32﹣)+c(HCO3﹣)+c(NH2COO﹣)+c(OH﹣)
C.随着CO2的通入, ![]() 不断增大
不断增大
D.在溶液pH不断降低的过程中,有含NH2COO﹣的中间产物生成
【答案】C
【解析】解:A.pH=9时,图象中各种离子浓度的大小关系:c(NH4+)>c(HCO3﹣)>c(NH2COO﹣)>c(CO32﹣),故A正确;
B.溶液中存在电荷守恒,即正电荷的总浓度等于负电荷的总浓度,则不同pH的溶液中存在电荷守恒关系为:c(NH4+)+c(H+)=2c(CO32﹣)+c(HCO3﹣)+c(NH2COO﹣)+c(OH﹣),故B正确;
C.已知Kb= ![]() ,温度一定时,Kb为常数,不随浓度的变化而变化,随着CO2的通入,c(NH4+)逐渐增大,则
,温度一定时,Kb为常数,不随浓度的变化而变化,随着CO2的通入,c(NH4+)逐渐增大,则 ![]() 不断减小,故C错误;
不断减小,故C错误;
D.由图象可知开始没有NH2COO﹣ , 后来也不存在NH2COO﹣ , 所以NH2COO﹣为中间产物,即在溶液pH不断降低的过程中,有含NH2COO﹣的中间产物生成,故D正确.
故选C.
A.根据pH=9时,图象中各种离子浓度的大小关系分析;
B.溶液中存在电荷守恒,即正电荷的总浓度等于负电荷的总浓度;
C.根据Kb= ![]() 分析;
分析;
D.根据图象可知开始没有NH2COO﹣ , 后来也不存在NH2COO﹣ .

练习册系列答案
相关题目