题目内容
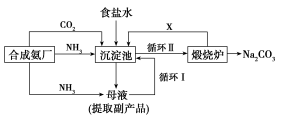
【题目】如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时,M、N两个电极的质量都不减少,请回答下列问题:
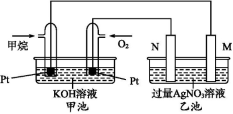
(1)乙池的名称:乙池是 装置。其中N电极的材料是 ,其电极名称是 。
(2)乙池的总反应化学方程式是 。
(3)甲池通入甲烷(CH4)的Pt电极的电极反应式为 。
(4)在此过程中,当乙池中某一电极析出金属2.16 g 时,甲池中理论上消耗标准状况下甲烷的体积为 mL,若此时乙池溶液的体积为400 mL,则乙池中H+的物质的量浓度为 。
【答案】
(1)电解池;石墨;阳极
(2)4AgNO3+2H2O![]() 4Ag+4HNO3+O2↑
4Ag+4HNO3+O2↑
(3)CH4-8e-+10OH-=CO32- +7H2O
(4)56;0.05 mol/L;
【解析】
试题分析:(1)根据图示,甲池是甲烷燃料电池,是原电池,乙池是电解池。原电池中通入甲烷的是负极,通入氧气的是正极,则N电极为阳极,应该选用石墨作电极,故答案为:电解池;石墨;阳极;
(2)乙池是电解硝酸银溶液的装置,总反应的化学方程式4AgNO3+2H2O![]() 4Ag+4HNO3+O2↑,故答案为:4AgNO3+2H2O
4Ag+4HNO3+O2↑,故答案为:4AgNO3+2H2O![]() 4Ag+4HNO3+O2↑;
4Ag+4HNO3+O2↑;
(3)甲池通入甲烷(CH4)的Pt电极的电极反应式为CH4-8e-+10OH-=CO32- +7H2O,故答案为:CH4-8e-+10OH-=CO32-+7H2O;
(4)2.16 g的金属是银,物质的量为![]() =0.02mol,转移电子的物质的量为0.02mol,则消耗甲烷的物质的量为
=0.02mol,转移电子的物质的量为0.02mol,则消耗甲烷的物质的量为![]() =0.0025mol,标准状况下甲烷的体积为0.0025mol×22.4L/mol=0.056L=56mL,根据4AgNO3+2H2O
=0.0025mol,标准状况下甲烷的体积为0.0025mol×22.4L/mol=0.056L=56mL,根据4AgNO3+2H2O![]() 4Ag+4HNO3+O2↑,生成是H+的物质的量为0.02mol,H+的物质的量浓度为
4Ag+4HNO3+O2↑,生成是H+的物质的量为0.02mol,H+的物质的量浓度为![]() =0.05 mol/L,故答案为:56;0.05 mol/L;
=0.05 mol/L,故答案为:56;0.05 mol/L;