题目内容
9.PH都等于2的盐酸(甲)和醋酸(乙)各100mL 分别与Zn反应,若最后Zn全部溶解且放出气体一样多,则有关叙述正确的是( )| A. | 反应开始时的速率:甲<乙 | |
| B. | 反应所需时间:甲>乙 | |
| C. | 反应开始前,酸的物质的量浓度:甲=乙 | |
| D. | 若使两酸溶液PH都等于5,则加水的体积:甲=乙 |
分析 A.反应速率与氢离子浓度成正比;
B.随着反应的进行,醋酸继续电离出氢离子,导致醋酸溶液中氢离子浓度大于盐酸,氢离子浓度越大,其反应速率越快,收集相同量的氢气反应时间越短;
C.pH相同的盐酸(甲)和醋酸(乙),醋酸是弱电解质,氯化氢是强电解质,所以c(HCl)<c(CH3COOH);
D.醋酸是弱电解质,在稀释过程中,醋酸电离度增大,所以要使溶液PH由2变到5,溶液体积要稀释到大于原来的1000倍,氯化氢是强电解质,要使溶液PH由2变到5,溶液体积要稀释到原来的1000倍即可.
解答 解:A.pH相同的盐酸(甲)和醋酸(乙),两种溶液中氢离子浓度相等,所以开始反应速率相等,故A正确;
B.反应过程中,醋酸电离导致醋酸中氢离子浓度减少速率小于盐酸中氢离子浓度减少速率,盐酸中的氢离子浓度小于醋酸中氢离子浓度,盐酸反应速率小于醋酸,所以反应所需时间为甲>乙,故B错误;
C.pH相同的盐酸(甲)和醋酸(乙),醋酸是弱电解质,氯化氢是强电解质,所以c(HCl)<c(CH3COOH),故C错误;
D.醋酸是弱电解质,在稀释过程中,醋酸电离度增大,所以要使溶液PH由2变到5,溶液体积要稀释到大于原来的1000倍,氯化氢是强电解质,要使溶液PH由2变到5,溶液体积要稀释到原来的1000倍即可,所以加水的体积:甲<乙,故D错误;
故选A.
点评 本题考查弱电解质的电离,易错选项是D,注意分情况分析,难度较大.

练习册系列答案
相关题目
17.下列关于水的说法不正确的是( )
| A. | 我们平时应多饮用很纯净的水,防止有毒物质进入体内 | |
| B. | 所有天然水都不能饮用 | |
| C. | 人体内含有约$\frac{2}{3}$体重的水,故人每天不用喝水也可 | |
| D. | 人类可利用的水只占自然界的水极少量,我们应节约用水 |
18.下列做法不应该提倡或者不正确的是( )
| A. | 采取低碳、节俭的生活方式,深入农村和社区宣传环保知识 | |
| B. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 | |
| C. | 热纯碱可以去油污,明矾可以净化水,漂白粉可用于漂白织物 | |
| D. | 海水淡化的方法有蒸馏法、电渗析法等 |
3.二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚(CH3OCH3).
请回答下列问题:
(1)利用水煤气合成二甲醚的三步反应如下:(甲醇:CH3OH)
①2H2(g)+CO(g)═CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=-41.3kJ•mol-1
则利用水煤气合成二甲醚的总反应的热化学方程式为3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-246.4kJ•mol-1.
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是ce(填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(2)、已知反应②2CH3OH(g)═CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正> v逆 (填“>”、“<”或“=”).
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04mol/L;该时间内反应速率v(CH3OH)=0.16 mol/(L•min).
请回答下列问题:
(1)利用水煤气合成二甲醚的三步反应如下:(甲醇:CH3OH)
①2H2(g)+CO(g)═CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=-41.3kJ•mol-1
则利用水煤气合成二甲醚的总反应的热化学方程式为3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-246.4kJ•mol-1.
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是ce(填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(2)、已知反应②2CH3OH(g)═CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04mol/L;该时间内反应速率v(CH3OH)=0.16 mol/(L•min).
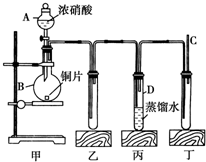 某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验.
某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验.