��Ŀ����
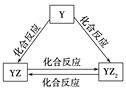
����Ŀ��Ԫ�������ڱ��е�λ�ã���ӳ��Ԫ�ص�ԭ�ӽṹ��Ԫ�ص����ʡ���ͼ��Ԫ�����ڱ���һ���֡�
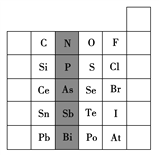
(1)��Ӱ����Ԫ��N��Ԫ�����ڱ��е�λ��Ϊ____���ڵ�____�塣����Ԫ�������ɣ�Ԥ������ǿ����H3AsO4____H3PO4(�>����<��)��
(2)S������ϼۺ���ͻ��ϼ۵Ĵ�����Ϊ____����һ�������£�S��H2��Ӧ��һ����(������Ϊ��Ӧ���еij̶�)�����жϣ�����ͬ������Se��H2��Ӧ�ij̶ȱ�S��H2��Ӧ�̶�____(�������С������ͬ��)��
(3)Br2���н�ǿ�������ԣ�SO2���н�ǿ�Ļ�ԭ�ԣ���SO2����ͨ����ˮ����Һ�д��ڵ���Ҫ������____��
(4)����˵���������____(�����)��
��C��N��O��F��ԭ�Ӱ뾶����ԭ���������������С
��Si��P��S��ClԪ�صķǽ��������ź˵���������Ӷ���ǿ
�۸ɱ�������Һ̬ˮת��Ϊ��̬ˮ��Ҫ�˷������ڵĹ��ۼ�
��HF��HCl��HBr��HI�����ȶ������μ���
���𰸡� 2 ��A < 4 ��С H����Br����SO![]() ��
��
��������������Ҫ����Ԫ�������ɡ�
(1)��Ӱ����Ԫ��N��Ԫ�����ڱ��е�λ��Ϊ���ڵ�VA�塣����Ԫ�������ɣ��ǽ�����ǿ����As<P����������ǿ����H3AsO4<H3PO4��
(2)S������ϼۺ���ͻ��ϼ۵Ĵ�����Ϊ4����һ�������£�S��H2��Ӧ��һ����(������Ϊ��Ӧ���еij̶�)���ǽ�����Sǿ��Se�����жϣ�����ͬ������Se��H2��Ӧ�ij̶ȱ�S��H2��Ӧ�̶ȸ�С��
(3)Br2���н�ǿ�������ԣ�SO2���н�ǿ�Ļ�ԭ�ԣ���SO2����ͨ����ˮ��Br2�߱���ԭΪBr-��SO2������ΪSO![]() ��ͬʱ����H+����Һ�д��ڵ���Ҫ������H����Br����SO
��ͬʱ����H+����Һ�д��ڵ���Ҫ������H����Br����SO![]() ��
��
(4)����˵��������Ǣۡ���C��N��O��FԪ������ͬ����Ԫ�أ�C��N��O��F��ԭ�Ӱ뾶����ԭ���������������С���ʢ���ȷ����Si��P��S��ClԪ������ͬ����Ԫ�أ�Si��P��S��ClԪ�صķǽ��������ź˵���������Ӷ���ǿ���ʢ���ȷ���۸ɱ�������Һ̬ˮת��Ϊ��̬ˮ��Ҫ�˷����Ӽ����������ʢ۴��ܷǽ����ԣ�F>Cl>Br>I������HF��HCl��HBr��HI�����ȶ������μ������ʢ���ȷ����ѡ�ۡ�

����Ŀ��ij��ѧС����ʵ����ģ�������̿���Ҫ�ɷ�![]() ������Ϊ����ͭ�Ļ�����ȣ��Ʊ��ߴ�̼���̣��������£����ֲ����������ԣ���
������Ϊ����ͭ�Ļ�����ȣ��Ʊ��ߴ�̼���̣��������£����ֲ����������ԣ���
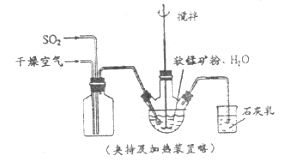
�ٻ�������ƿ�У�����ͼ��ͨ�������������С����̡���������Ҫ��Ӧԭ��Ϊ�� ![]()
![]() ��������������
��������������![]() �Ὣ
�Ὣ![]() ��ԭΪ
��ԭΪ![]() ��
��
�����̡����������ƿ�м���һ������![]() ��ĩ��
��ĩ��
������![]() ��Һ����pHΪ3.5���ң����ˡ�
��Һ����pHΪ3.5���ң����ˡ�
�ܵ�����ҺpHΪ6.5-7.2������![]() ����dz��ɫ�������ɣ����ˡ�ϴ�ӡ�����õ��ߴ�̼���̡�
����dz��ɫ�������ɣ����ˡ�ϴ�ӡ�����õ��ߴ�̼���̡�
��1�������̡���Ӧ�������и�����![]() �����ɣ��¶ȶԡ����̡���Ӧ��Ӱ������ͼ��Ϊ����
�����ɣ��¶ȶԡ����̡���Ӧ��Ӱ������ͼ��Ϊ����![]() �����ɣ������̡��������¶���___________��
�����ɣ������̡��������¶���___________��
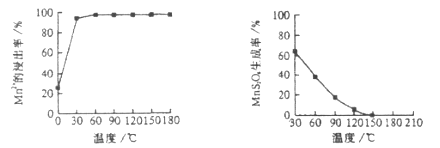
ͼ1 �¶ȶ��̽����ʵ�Ӱ�� ͼ2 �����¶���![]() �����ʵĹ�ϵ
�����ʵĹ�ϵ
��2�����ı�1�����е�pHΪ3.5ʱ��������Ҫ�ɷ���________�����м���һ������![]() ��ĩ����Ҫ������_________����Ӧ��Ӧ�����ӷ���ʽΪ_______��
��ĩ����Ҫ������_________����Ӧ��Ӧ�����ӷ���ʽΪ_______��
��1��������Ӧ���������pH
���� |
|
|
|
|
| ��ʼ����pH | 2.7 | 7.6 | 8.3 | 4.7 |
��ȫ����pH | 3.7 | 9.6 | 9.8 | 6.7 |
��3���������õ���Һ�к���![]() �������ӹ��������ܵ����MnS��ȥ
�������ӹ��������ܵ����MnS��ȥ![]() �������ˣ��õ�������
�������ˣ��õ�������![]() ����ƽ���ƶ�ԭ�����ͼ���MnS������__________��
����ƽ���ƶ�ԭ�����ͼ���MnS������__________��
��4�����м���![]() ������Ӧ�����ӷ���ʽ��__________��
������Ӧ�����ӷ���ʽ��__________��