题目内容
氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
(1)配平上述反应的化学方程式(将化学计量数填在方框内)
(2)该反应中的氧化剂是
(3)该反应的平衡常数表达式为K=
;
(4)若知上述反应为放热反应,则其反应热为△H
(5)若使压强增大,则上述平衡向
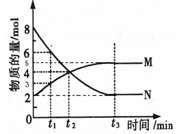
(6)若已知CO生成速率为v(CO)=18mol/(L?min)则N2的消耗速率为v(N2)=
3
3
SiO2+6
6
C+2
2
N2| 高温 |
1
1
Si3N4+6
6
CO(1)配平上述反应的化学方程式(将化学计量数填在方框内)
(2)该反应中的氧化剂是
N2
N2
,其还原产物是Si3N4
Si3N4
;(3)该反应的平衡常数表达式为K=
| C6(CO) |
| C2(N2) |
| C6(CO) |
| C2(N2) |
(4)若知上述反应为放热反应,则其反应热为△H
小于
小于
零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值减小
减小
(填“增大”、“减小”或“不变”)(5)若使压强增大,则上述平衡向
逆
逆
反应方向移动(填“正”或“逆”);(6)若已知CO生成速率为v(CO)=18mol/(L?min)则N2的消耗速率为v(N2)=
6
6
mol/(L?min).分析:(1)根据氧化还原反应化合价升降总数相等以及质量守恒来解答;
(2)根据氧化剂、还原产物的概念;
(3)根据化学平衡常数的含义;
(4)根据放热反应,△H<0,以及温度对化学平衡的影响、平衡常数的影响,
(5)根据压强对化学平衡的影响;
(6)根据速率之比等于化学计量数之比;
(2)根据氧化剂、还原产物的概念;
(3)根据化学平衡常数的含义;
(4)根据放热反应,△H<0,以及温度对化学平衡的影响、平衡常数的影响,
(5)根据压强对化学平衡的影响;
(6)根据速率之比等于化学计量数之比;
解答:解:(1)Si的化合价前后未变,N的化合价由0升为-3,C的化合价由0升为+2,生成1个Si3N4化合价降低12,生成1个CO化合价升高2,根据化合价升降总数相等以及质量守恒得,SiO2+6C+2N2
Si3N4+6CO,故答案为:3、6、2、1、6;
(2)化合价降低的反应物是氧化剂,氧化剂被还原得到的生成物是还原产物,故答案为:N2; Si3N4;
(3)化学平衡常数表达式为K=
,故答案为:
;
(4)因反应是放热反应,所以△H<0,温度升高,平衡逆向移动,反应物的浓度增大,生成物浓度减少,平衡常数减小,故答案为:小于;减小;
(5)压强增大,平衡向气体体积减小的方向移动,即逆反应方向,故答案为:逆;
(6)速率之比等于化学计量数之比,即v(N2)=
v(CO)=6mol/(L?min),故答案为:6.
| 高温 |
(2)化合价降低的反应物是氧化剂,氧化剂被还原得到的生成物是还原产物,故答案为:N2; Si3N4;
(3)化学平衡常数表达式为K=
| C6(CO) |
| C2(N2) |
| C6(CO) |
| C2(N2) |
(4)因反应是放热反应,所以△H<0,温度升高,平衡逆向移动,反应物的浓度增大,生成物浓度减少,平衡常数减小,故答案为:小于;减小;
(5)压强增大,平衡向气体体积减小的方向移动,即逆反应方向,故答案为:逆;
(6)速率之比等于化学计量数之比,即v(N2)=
| 1 |
| 3 |
点评:本题是一道综合题,主要考查了氧化还原反应、化学平衡常数、化学平衡移动、化学反应速率的计算,难度不大.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
 氮化硅是一种新型陶瓷材料,它可由石英晶体与焦炭颗粒在高温的氮气流中,通过如下反应制得:3SiO2+6C+2N2
氮化硅是一种新型陶瓷材料,它可由石英晶体与焦炭颗粒在高温的氮气流中,通过如下反应制得:3SiO2+6C+2N2 Si3N4+6CO,该反应过程中的能量变化如图所示;回答下列问题:
Si3N4+6CO,该反应过程中的能量变化如图所示;回答下列问题: 氮化硅是一种新型陶瓷材料的主要成分,能承受高温,可用于制造业、航天业等领域.图是氮、硅的原子结构示意图,请推测氮化硅的化学式(分子式)为( )
氮化硅是一种新型陶瓷材料的主要成分,能承受高温,可用于制造业、航天业等领域.图是氮、硅的原子结构示意图,请推测氮化硅的化学式(分子式)为( ) 该反应过程中的能量变化如图所示,回答下列问题。
该反应过程中的能量变化如图所示,回答下列问题。 Si3N4 + 6CO,该反应过程中的能量变化如图所示;回答下列问题:
Si3N4 + 6CO,该反应过程中的能量变化如图所示;回答下列问题:
 (正)
(正)