题目内容
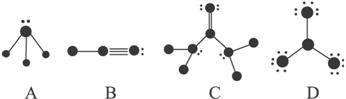
下列结构图中![]() 代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未形成共价键的最外层电子,短线代表价键,如:F2
代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未形成共价键的最外层电子,短线代表价键,如:F2![]() 。
。
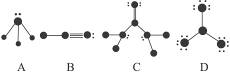
根据各图所示的结构特点,写出相应分子的化学式:
A:____________________________________________________________________________;
B:____________________________________________________________________________;
C:____________________________________________________________________________;
D:____________________________________________________________________________。
NH3 HCN CO(NH2)2 BF3
解析:
此题是让我们看图识分子。考生通过分析1—10号元素原子的化合价和化学键后,便能顺利辨认出这些分子。
A图,显然是NH3。第一,它是一个三角锥型分子;第二,它有一对电子未参加成键,3个价电子用于形成3个单键,最外层应有5个电子,必为N原子。而与N相连的原子只有一个价电子,故只可以是H原子。
B图是H—C≡H。这是因为:第一,它是直线型分子;第二,中间一个原子化合价为4,所以是C,左边原子化合价为1,且只有一个价电子,故为H,而右边原子显然是N。
C图是![]() 。从图可看出,顶上的原子是O原子,它用2个价电子与C形成两对共用电子。左、右两边与C相连的显然是N原子,同理与N相连的两个只含1个价电子的原子显然是H原子。
。从图可看出,顶上的原子是O原子,它用2个价电子与C形成两对共用电子。左、右两边与C相连的显然是N原子,同理与N相连的两个只含1个价电子的原子显然是H原子。
D图是BF3。在1—10号元素中价电子为7的只有F原子,每个F各用一个价电子与中间原子形成单键,而中间一个原子只有3个价电子,应该是B原子,故该分子是平面三角型结构的BF3。

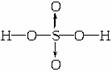 ,硝基甲烷
,硝基甲烷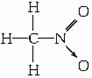 ,写出三硝酸甘油酯的结构式:_________。
,写出三硝酸甘油酯的结构式:_________。