题目内容
9.下列有机物的命名正确的是( )| A. | 2-乙基戊烷 | B. | 1,2-二甲基丁烷 | ||
| C. | 2,2,4-三甲基戊烷 | D. | 2一乙基一3一甲基已烷 |
分析 1、碳链最长称某烷:选定分子里最长的碳链做主链,并按主链上碳原子数目称为“某烷“;
2、靠近支链把号编:把主链里离支链较近的一端作为起点,用1、2、3…等数字给主链的各碳原子编号定位以确定支链的位置;
3、简单在前同相并,其间应划一短线:把支链作为取代基,把取代基的名称写在烷烃名称的前面,在取代基的前面用阿拉伯数字注明它在烷烃主链上的位置,而且简单的取代基要写在复杂的取代基前面,如果有相同的取代基,则要合并起来用二、三等数字表示,但是表示相同的取代基位置的阿拉伯数字要用逗号隔开,并在号数后面连一短线,中间用“-“隔开.
解答 解:A、2-乙基戊烷,烷烃命名中出现2-乙基,说明选取不是最长碳链,正确命名为3-甲基己烷,故A错误;
B、烷烃命名中无1-甲基,正确命名为2-甲基戊烷,故B错误;
C、2,2,4-三甲基戊烷,符合烷烃命名原则,故C正确;
D、烷烃命名中出现2-乙基,不是选取最长碳链,正确命名为:3,4-二甲基庚烷,故D错误,故选C.
点评 本题考查了有机物的命名,题目难度中等,试题侧重对学生基础知识的检验和训练,解题的关键是明确有机物的命名原则,然后结合有机物的结构简式灵活运用即可,试题培养了学生规范答题的能力.

练习册系列答案
相关题目
19.c(H+)均为0.1mol•L-1的两种一元酸HX和HY溶液,分别取100mL加入足量的镁粉.充分反应后,收集到体积分别为VHX和VHY若相同条件下VHX>VHYX,则下列说法正确的是( )
| A. | HX可能是强酸 | B. | HY一定是强酸 | ||
| C. | HX的酸性强于HY的酸性 | D. | 反应开始时二者生成的速率相等 |
20.已知2SO2(g)+O2(g)═2SO3(g)(正反应方向放热).若在500℃和催化剂的作用下,往容器中加入SO2和O2,该反应在容积固定的密闭容器中进行,下列有关说法正确的是( )
| A. | 若降低温度,可以加快反应速率 | |
| B. | 使用催化剂是为了加快反应速率 | |
| C. | 随着反应的进行,逆反应速率逐渐增大,最后不变 | |
| D. | 达到化学平衡状态时,SO2和SO3的浓度一定相等 |
4.常温下,有①Na2CO3溶液;②NaHCO溶液;③氨水;④NH4Cl溶液各25mL,其物质的量浓度均为0.1mol.L-1.关于上述四种溶液的说法正确的是( )
| A. | 水的电离程度:①<② | |
| B. | ①、②中粒子浓度关系均符合:c(Na+)+c(H+)=c(OH+)+c(HCO2-)+c(CO32-) | |
| C. | 将③、④混合,所得溶液的pH>7,则该溶液中:c(NH4+)+c(NH3.H2O)<0.1mol.L-1 | |
| D. | 向③、④中分别加入25mL0.1mol.L-1盐酸后,溶液中c(NH4+):③<④ |
14.下列溶液中含Cl-物质的量浓度最大的是( )
| A. | 30mL0.2mol/LKCl溶液 | B. | 20mL0.1mol/LCaCl2溶液 | ||
| C. | 10mL0.1mol/LAlCl3溶液 | D. | 100mL0.25mol/LNaCl溶液 |
1.已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;
化学反应②:Fe(s)+H2O(g)?FeO(s)+H2(g),其平衡常数为K2,
在温度973K和1173K情况下,K1、K2的值分别如下:
(1)通过表格中的数值可以推断:反应①是吸热(填“吸热”或“放热”)反应.
(2)现有反应③:CO2(g)+H2(g)??ΧΟ(γ)+Η2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=$\frac{[CO][H{\;}_{2}O]}{[H{\;}_{2}][CO{\;}_{2}]}$.
(3)根据反应①与②可推导出K1、K2与K3之间的关系式$\frac{K{\;}_{1}}{K{\;}_{2}}$,据此关系式及上表数据,也能推断出反应③是吸热(填“吸热”或“放热”)反应.
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,
可采取的措施有CE(填写字母序号).
A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.使用合适的催化剂 E.设法减小平衡体系中的CO的浓度.
化学反应②:Fe(s)+H2O(g)?FeO(s)+H2(g),其平衡常数为K2,
在温度973K和1173K情况下,K1、K2的值分别如下:
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
(2)现有反应③:CO2(g)+H2(g)??ΧΟ(γ)+Η2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=$\frac{[CO][H{\;}_{2}O]}{[H{\;}_{2}][CO{\;}_{2}]}$.
(3)根据反应①与②可推导出K1、K2与K3之间的关系式$\frac{K{\;}_{1}}{K{\;}_{2}}$,据此关系式及上表数据,也能推断出反应③是吸热(填“吸热”或“放热”)反应.
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,
可采取的措施有CE(填写字母序号).
A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.使用合适的催化剂 E.设法减小平衡体系中的CO的浓度.
18.下列溶液中物质的量浓度为1mol•L-1的是( )
| A. | 10 g NaOH固体溶解在水中配成250mL溶液 | |
| B. | 将22.4L氯化氢气体溶于水配成1L溶液 | |
| C. | 将1L 10 mol•L-1的浓盐酸与9L水混合 | |
| D. | 将40g NaOH固体溶解于1L水中 |
19.亚硝酸(HNO2)既可作氧化剂又可作还原剂.当亚硝酸在反应中作氧化剂时,可能生成的产物是( )
| A. | N2 | B. | N2O3 | C. | NH3 | D. | NO2 |
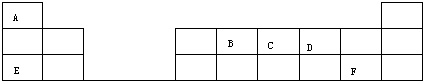
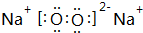 F的原子结构示意图为
F的原子结构示意图为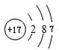 .
.