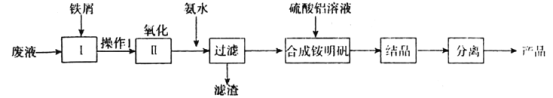
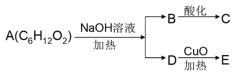
题目内容
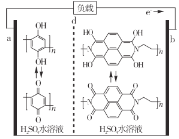
【题目】中国科学院大连化物所的研究团队创新性提出锌碘单液流电池的概念, 实现锌碘单液流中电解液的利用率近 100%, 其原理如图所示。
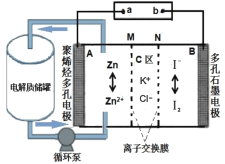
下列说法正确的是
A.放电时A电极反应式为:Zn+2e-=Zn2+B.放电时电解质储罐中离子总浓度减小
C.M为阴离子交换膜,N为阳离子交换膜D.充电时A极增重65g,C区增加离子数为2NA
【答案】C
【解析】
A. 放电时,B电极为正极,I2得到电子生成I,电极反应式为I2+2e=2I,A电极是负极,电极反应式为Zn2e═Zn2+,故A错误;
B. 放电时,左侧即负极,电极反应式为Zn2e═Zn2+,右侧是正极,电极反应式为I2+2e=2I,所以储罐中的离子总浓度增大,故B错误;
C. 离子交换膜是防止正负极I2、Zn接触发生自发电,负极区生成Zn2+,正电荷增加,正极区生成I,负电荷增加,所以Cl通过M膜进入负极,K+通过N膜进入正极,所以M为阴离子交换膜,N为阳离子交换膜,故C正确;
D. 充电时,A极反应式Zn2e═Zn2+,A极增重65g转移2mol电子,所以C区增加2molK+、2molCl,离子总数为4NA,故D错误;
故选:C。

练习册系列答案
相关题目