题目内容
下列分子或离子属等电子体的是
| A.CH4和NH3 | B.NO3-和CO32- | C.H3O+ 和PCl3 | D.CS2和SO2 |
B
解析试题分析:原子总数和价电子总数分别都相同的分子或离子称为等电子体,等电子体间结构和性质相似(等电子原理)。A、甲烷分子中含有5个原子,氨气分子中含有4个原子,所以不是等电子体,故A错误;B、硝酸根离子和碳酸根离子都含有4个原子,其价电子数都是24,所以是等电子体,故B正确;C、H3O+和PCl3都含有4个原子,水合氢离子价电子数是8,PCl3价电子数是26,所以不是等电子体,故C错误;D、CS2和SO2分子中都含有3个原子,CS2中价电子数是16,SO2中价电子数是18,所以不是等电子体,故D错误,答案选B。
考点:考查等电子体的判断

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
元素X、Y和Z可结合形成化合物XYZ3;X、Y和Z的原子序数之和为26;Y和Z在同一周期。下列有关推测正确的是( )
| A.XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XY |
| B.XYZ3是一种微溶于水的盐,且Y与Z可形成共价化合物化合物YZ或YZ2 |
| C.XYZ3是一种易溶于水的盐,且X与Z可形成离子化合物XZ |
| D.XYZ3是一种离子化合物,且Y与Z可形成离子化合物YZ3 |
医学上在对抗癌物质的研究中发现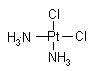 具有抗癌作用,而
具有抗癌作用,而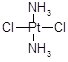 没抗癌作用。对此下列叙述正确的是( )
没抗癌作用。对此下列叙述正确的是( )
| A.两者互为同分异构体,都是以Pt原子为中心的四面体结构 |
| B.两者互为同分异构体,都是以Pt原子为中心的平面结构 |
| C.两者为同一物质,都是以Pt原子为中心的四面体结构 |
| D.两者为同一物质,都是以Pt原子为中心的平面结构 |
在预防甲型H1N1流感疫情时,防疫部门使用了含氯类消毒剂,其中的氯胺是一种长效缓释有机氯消毒剂,有强氧化性,其杀菌能力是一般含氯消毒剂的4—5倍,下列有关氯胺(NH2Cl)的说法一定不正确的是
| A.氯胺水解产物为NH2OH(羟氨)和HCl |
| B.氯胺的消毒原理与漂白粉相似 |
| C.氯胺中氯的化合价为+1 |
D.氯胺的电子式为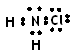 |
有关理论认为N2O与CO2分子具有相似的结构(包括电子式);已知N2O分子中氧原子只与一个氮原子相连,下列说法合理的是
| A.N2O与SiO2为等电子体、具有相似的结构(包括电子式) |
B.N2O的电子式可表示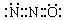 |
| C.N2O与CO2均不含非极性键 |
| D.N2O为三角形分子 |
某物质化学式为NH5,常温下为固体,能与水剧烈反应放出两种气体,且在NH5中的各原子均具有稀有气体的稳定结构,则下列有关NH5的描述中不正确的是( )
| A.组成NH5的元素都是非金属,属于共价化合物 |
| B.NH5中氢元素为+1价 |
| C.NH5与水的反应是氧化还原反应 |
| D.NH5溶于水后溶液呈碱性 |
下列有关σ键和π键的说法正确的是
| A.σ键是镜像对称,而π键是轴对称 |
| B.π键是由两个p电子“头碰头”重叠形成的 |
| C.σ键可沿键轴自由旋转而不影响键的强度 |
| D.π键比σ键重叠程度大,形成的共价键强 |
下列关于化学变化的叙述错误的是
| A.化学变化一定伴随能量变化 |
| B.化学变化一定有化学键的断裂和生成 |
| C.化学变化一定伴随物质的状态变化 |
| D.化学变化一定有新物质生成 |
下面有关离子化合物的说法正确是
| A.离子化合物中一定含有金属元素,含金属元素的化合物一定是离子化合物。 |
| B.离子键只存在于离子化合物中,离子化合物中一定含有离子键 |
| C.离子化合物中不可能含有共价键 |
| D.离子化合物受热融化破坏化学键,吸收能量,属于化学变化 |